肿瘤精准医疗从实验研究到临床评价,已得到深入而广泛的探索,以达到个体化治疗和改善患者预后的目的。然而,基于基因型的肿瘤精准医疗存在一定的局限性或不足。肿瘤微环境(TME)内持续肿瘤增殖期间的基因组不稳定性导致肿瘤内和肿瘤间的异质性,导致耐药性和治疗失败。因此,TME内部引发的相互作用网络阻碍了精准肿瘤治疗的临床应用。需要进一步开发临床前模型来研究TME并指导临床精准治疗。
鉴于肿瘤内的异质肿瘤细胞和肿瘤相关细胞对复杂细胞间相互作用的进展贡献不均,使用2D肿瘤细胞系的肿瘤研究结果受到了挑战。癌症类器官保留了TME的3D结构,为分子相互作用提供了物理背景。近年来,研究人员建立了肿瘤类器官共培养模型,用于阐明细胞间相互作用、肿瘤免疫反应机制和肿瘤转移机制。
在中国医学科学院北京协和医学院骨科研究团队的一项综述中,梳理了肿瘤类器官在人体多系统肿瘤研究中的应用,讨论了肿瘤类器官模型系统在基因组分析和药物筛选中的应用,并分析了一种新的肿瘤类器官共培养模型系统,以及其在研究细胞间相互作用、肿瘤内免疫反应以及肿瘤进化和个性化精准医疗的潜在机制方面的应用。这篇综述提供了一个更好的视角,帮助研究人员将这种实用方法应用于肿瘤研究和精准医学。研究成果发表在 Frontiers in Immunology 期刊题为“Cancer organoid co-culture model system: Novel approach to guide precision medicine”。

类器官是一种干细胞衍生的3D细胞培养物,它获得了相应组织的结构、多种细胞类型的集合和功能。在过去的几十年里,对干细胞的大量研究使人们更好地了解了它们的行为,出现了控制干细胞自组织和分化的方法,这为进一步建立类器官提供了科学依据。干细胞有两种类型,一个是胚胎干细胞(ESCs),另一个是成体干细胞(ASCs)。ESCs具有发育全能性,可以分化成所有细胞类型,ASCs是未分化的干细胞,具有在特定器官中分化,维持稳态和再生的能力。自1981年以来,干细胞研究的重大科学进步为类器官开发铺平了道路(图1)。类器官形成和生长的关键点是培养条件是否复制了干细胞的体内生态位信号通路,这有助于维持干细胞功能和诱导分化。
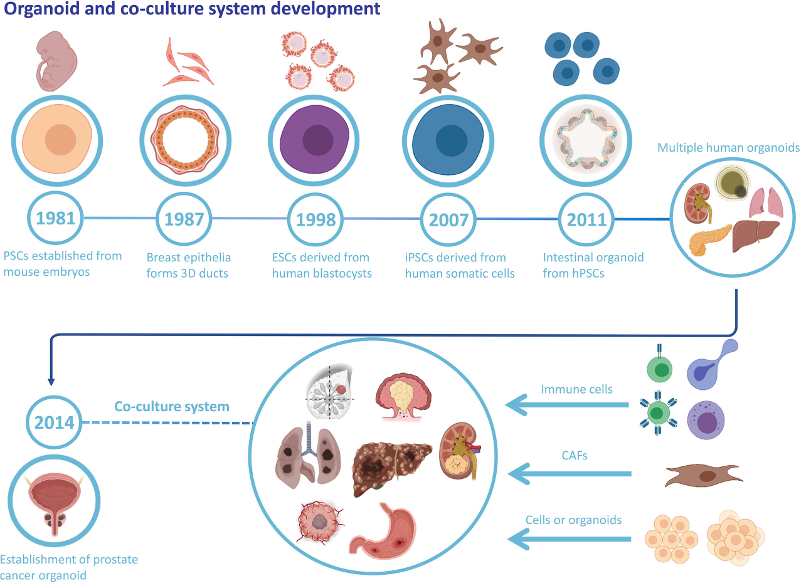
图1 类器官和共培养系统开发。类器官和肿瘤类器官的历史以及各种肿瘤类器官和特定细胞类型的成熟共培养系统。
近年来,各种肿瘤类器官,包括结直肠癌(CRC),乳腺癌,肝细胞癌和非小细胞肺癌,已被开发用于药物筛选,放疗筛选,基因组编辑,移植和肿瘤基因鉴定。大多数肿瘤类器官是从患者来源的肿瘤样本中获得的,并在ASCs-类器官条件下生成,但CRISPR-Cas9核酸酶基因组编辑系统也建立了少数。
各种肿瘤类器官的产生需要不同的方法,没有标准化的培养基或实验程序,最佳组织通常从肿瘤边缘获得,坏死率最低。一般来说,整个过程是通过机械力和酶将肿瘤样本消化成~1mm直径的碎片,然后将组织悬浮液作为仿生支架接种到Matrigel上。与培养健康类器官不同,肿瘤类器官培养首选生长因子降低的培养基,以减少克隆选择并避免混淆药物治疗效果。用于肿瘤类器官培养的生长因子包括Wnt3A、R-spondin-1、TGF-β受体抑制剂、表皮生长因子和Noggin,但这些因子在培养基中添加的组合和浓度取决于特定的癌症类型。与初始培养过程相比,类器官传代是培养过程中更简单但必不可少的过程,必须关注的问题是可用于研究的癌症类器官的传代数。
随着肿瘤类器官开发的进步,其已成为肿瘤研究中被广泛接受的实用模型(图2)。肿瘤类器官主要用于个性化医疗方法的药物筛选。患者来源类器官(PDOs)的药物反应主要模拟患者对相同药物的初始反应。这些研究表明,驱动致癌途径的基因变化与这种疗法相对应。因此,药物筛选是肿瘤研究中肿瘤类器官应用的首要环节,以筛选最有效的药物并预测其治疗效果。
肿瘤类器官的原位移植已在临床前模型中建立。测序分析通常用于鉴定类型特异性差异表达的基因。进行RNA测序分析和全外显子组测序以鉴定肿瘤相关基因。此外,随着时间的推移,这些技术是肿瘤类器官的主要认证方法,靶向测序用于识别靶点突变。CRISPR-Cas9技术在基因组编辑领域的革命性技术,已应用于类器官研究。
肿瘤类器官现在是肿瘤研究中的多功能工具,但是也存在一些缺点。类器官仅包括上皮层,而没有周围间充质、免疫细胞、神经系统或肌肉层等天然微环境。开发一种新型的肿瘤类器官与其他细胞或类器官共培养模型系统可以概括细胞间相互作用。此外,应改进培养基以促进类器官生长和长期扩增,同时尽量减少培养基中生长因子对类器官行为的影响。
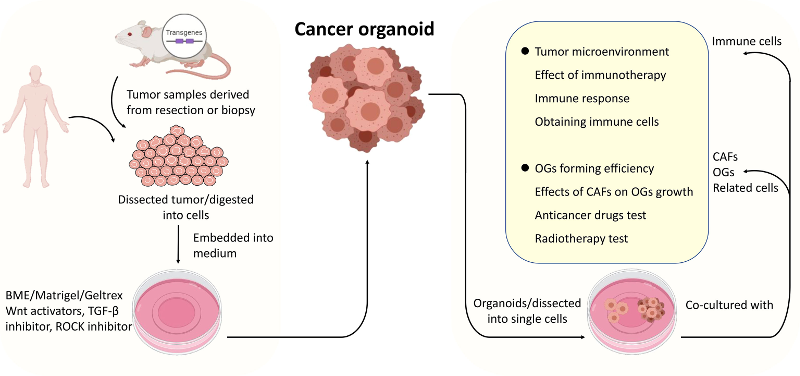
图2 肿瘤类器官建立的程序及共培养系统的应用。将来自手术切除的肿瘤或活检的肿瘤组织解剖成小块或消化成细胞,与基质胶混合,并在补充有特定生长因子的培养基中培养。将肿瘤类器官(无论是否解剖成细胞)与类器官、癌症相关成纤维细胞或相关细胞(主要是免疫细胞)共培养,以模拟肿瘤或TME内特定细胞之间的相互作用。
共培养是一种在同一培养环境中直接或间接培养多种不同细胞类型的方法。建立肿瘤类器官共培养模型有三个主要目的。第一个也是最常见的应用是通过肿瘤内特定细胞类型之间的直接或间接相互作用来驱动类器官的形成。第二个是产生特异性肿瘤靶向细胞毒性免疫细胞,用于使用肿瘤类器官进行肿瘤治疗。第三个是检测肿瘤类器官和特定细胞之间的免疫串扰,这种串扰通常是通过一个细胞群的悬浮来实现的,通常是肿瘤相关的成纤维细胞,通过分泌信号因子和细胞因子来调节类器官的培养基。此外,肿瘤类器官与特定类型细胞的共培养系统可用于不同的研究目的,并且肿瘤类器官与多种类型细胞的共培养可以准确地模拟肿瘤状况。
Farin等人建立了CRC类器官和CAFs(肿瘤相关成纤维细胞)共培养物,获得了CRC中成纤维细胞可塑性的体外模型,揭示了共培养增加了由Wnt和IWP-2调节的CAFs的收缩性。此外,还开发了用于药物测试和阐明CRC-CAF串扰的CRC PDO-CAF模型,表明CAFs在不添加生长因子的情况下维持了水凝胶中CRC类器官的增殖,并恢复了CRC类器官单独培养中缺失的、但存在于肿瘤中的独特信号通路。这表明CRC-CAF共培养模型适用于药物评估,并有助于我们更接近个性化肿瘤药物的目标。同样,CAFs还促进了体外HCC肿瘤类器官和移植异种移植模型的生长。CAFs对肿瘤进展至关重要,CAFs和肿瘤类器官的共培养可以概括肿瘤起源内的TME。
肿瘤类器官共培养模型的主要应用是与免疫细胞的共培养,包括细胞毒性T淋巴细胞和树突状细胞,NK细胞,巨噬细胞和淋巴细胞。为了获得肿瘤反应性T细胞,添加外周血淋巴细胞并与非小细胞肺癌类器官共培养,为产生用于过继T细胞转移的患者特异性T细胞提供了临床可行的策略。最近,开发了一种新颖的共培养方法来预测精准医学的疗效,以实现对胃癌患者的更好预后,使用癌症抗原刺激抗原呈递树突状细胞(DC),然后与CD8+ T细胞共培养以促进这些T细胞的细胞溶解和增殖,然后与患者来源的胃癌类器官共培养。这种方法可能被认为在TME中更相关,而不是由人工方法诱导T细胞活化。PDO与免疫细胞联合检查点阻断抑制剂共培养已被应用于肿瘤精准医学的一系列研究,为预测PDO的精准治疗效果提供了重要的见解。这个过程需要近十天,包括手术切除后的肿瘤类器官建立、免疫细胞的制备、共培养、药物测试和疗效测定。这种新颖的平台可以在微观水平上指导临床治疗,并使患者受益,而无需基于类器官培养技术的进步而需要长时间的等待。
CAR-T细胞是经过基因工程改造以表达靶向特定抗原的嵌合受体的 T 细胞,通过直接的T细胞毒性来明确识别和消除癌细胞。肿瘤类器官和CAR-T细胞的共培养为预测CAR-T细胞功效和毒性评估提供了一个平台。最近,Chen等人建立了一个成功的临床前测试离体技术平台,用于共培养模型系统,以评估CAR-T细胞介导的针对MUC1的膀胱癌类器官的细胞毒性。肿瘤类器官保留了肿瘤起源的组织学特征、细胞多样性、遗传异质性和突变多样性。因此,CAR来源细胞和肿瘤类器官的共培养可以充分捕获免疫治疗的分子和细胞过程,在预测治疗效果和细胞毒性方面显示出巨大的潜力。
癌症类器官有一个主要缺点:免疫细胞和特定类型的肿瘤相关基质细胞类器官较少。肿瘤类器官共培养模型系统似乎可以解决这个问题(图3)。这种方法可能被认为更接近TME内部发生的情况。关于肿瘤相关细胞的共培养,CAFs占大多数肿瘤类器官共培养研究。CAFs作为TME的重要补充,已被证明可以促进肿瘤进展并促进治疗耐药性。

图3 肿瘤类器官共培养的四种条件综述。
由于保持异质性和TME,CAR-工程淋巴细胞和肿瘤类器官的先进技术在个性化医疗中具有优势。CAR-工程淋巴细胞结合类器官在药物测试、基因组编辑和高通量筛选中的应用将是未来的研究方向。然而,由于CAR-T细胞免疫疗法在实体瘤中的治疗效果不如在血癌中的治疗效果,这是由于TME中运输不良、持久性有限、浸润有限以及T细胞抑制活性有限,因此迄今为止在这一领域的研究很少。因此,有人提出检查点阻断抑制剂与CAR-工程细胞相结合是一种有前途的实体瘤治疗方法,其类器官平台可提供环境的再现。最近,CAR-工程细胞疗法已扩展到新型细胞类型,NK细胞中CAR的表达被认为是一种更成功的变体。基于肿瘤类器官的共培养系统可以为评估过继细胞疗法的临床治疗效果提供一个平台。此外,必须鉴定特定癌细胞中改变的表面抗原中的基因突变,为该方法提供主要证据,以实现更高的靶向和治疗效率。为了扩大其应用范围,需要进一步研究建立用于类器官肿瘤研究的各种共培养模型系统。
参考文献:Yuan J, Li X, Yu S. Cancer organoid co-culture model system: Novel approach to guide precision medicine. Front Immunol. 2023 Jan 12;13:1061388. doi: 10.3389/fimmu.2022.1061388. PMID: 36713421; PMCID: PMC9877297.
原文链接:https://pubmed.ncbi.nlm.nih.gov/36713421/
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。如有任何的想法以及建议,欢迎联系小编。感谢各位的浏览以及关注!
微信搜索公众号“Naturethink”,了解更多细胞体外仿生培养技术及应用。
点击了解
细胞流体剪切力|共培养|压力培养|牵张应变|血管培养|平行平板流动腔|仪器|上海泉众机电科技有限公司
多细胞培养|共培养体系|共培养模型|共培养实验|动态细胞共培养|仿血流多细胞动态共培养系统

新鲁汶大学的公报指出,如今抗生素耐药菌的出现给人类和医药带来了新 ...

根据“生物安全关键技术研发”重点专项评审工作安排,生物中心将于2 ...

为更好的向用户、潜在用户提供我们的产品,即日起推出如下活动:凡向 ...

2018年度国家科学技术奖提名工作已结束,国家科学技术奖励工作办 ...

据英国《自然·通讯》杂志日前发表的一篇医学论文报告,科学家发现了 ...

Naturethink祝愿伟大祖国繁荣昌盛,欣欣向荣! ...

“免疫系统在高血压中扮演了未曾预料的重要角色。”英国格拉斯哥大学 ...

“来一场中国制造的品质革命!”3月5日,李克强总理在政府工作报告 ...

我司自主研发产品,重视知识产权,已拥有多项专利证书! ...

美国侨报网近日刊文称,一项新出炉的研究警告称,即使是失眠一夜,也 ...
公司完成细胞张应变与压力综合培养仪器的研发; ...

Naturethink网站及微信内容逐步完善,敬请查阅! ...

为提高区域自主创新能力,推进区域科技创新体系建设,加大创新驱动区 ...

2018年春节将至,我司放假时间安排为:2月14日至2月21日, ...

澳大利亚和英国一项研究显示,对于几乎任何年龄段的人群而言,快走都 ...

2018年国家自然科学基金项目申请工作已开始,你准备好了吗? ...
壁面剪切应力(WSS),是单位面积上由血管表面流动的液体产生的接 ...
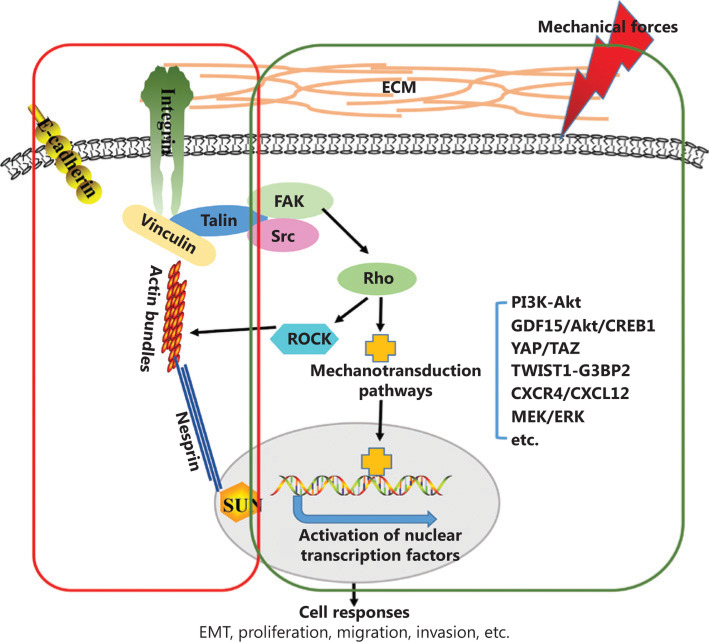
癌症在促进肿瘤表型表观遗传重编程和修饰的复杂组织微环境中发展。此 ...