间充质干细胞(MSCs)已被应用于治疗各种不治之症,并且大量研究已经探索了与其治疗特性相关的旁分泌和抗炎作用。已知间充质干细胞会迁移到受损组织或炎症部位,在那里它们受到干扰素(IFN)-γ、TNF-α或白细胞介素(IL)-1β等炎性细胞因子的刺激,以表达各种免疫抑制因子,包括吲哚胺2,3-双加氧酶(IDO)、前列腺素E2(PGE2)、肿瘤坏死因子(TNF)-α刺激基因-6(TSG-6)、一氧化氮(NO)、IL-6、IL-10等。巨噬细胞在炎症部位分泌包括TNF-α和IL-1β在内的各种炎性细胞因子,它们可以通过间充质干细胞诱导TSG-6的表达。
TSG-6是一种与炎症相关的多功能蛋白,具有抗炎和组织保护特性。此外,TSG-6在炎性细胞迁移、细胞增殖和发育过程中起重要作用。TSG-6可通过调节内皮细胞、中性粒细胞、肥大细胞、巨噬细胞泡沫细胞、血管平滑肌细胞和巨噬细胞的迁移和增殖来抑制炎症反应。TSG-6可通过抑制TGF-β信号通路来调节成纤维细胞的生长,从而达到抗纤维化的效果。
暴露于炎症环境的MSCs可以通过表达TSG-6来调节炎症细胞的活性来再生受损组织。尽管包括TNF-α和IL-1β在内的炎性细胞因子可以增加TSG-6表达,但对MSCs和巨噬细胞之间TSG-6表达的关系知之甚少。
基于此,韩国延世大学原州医学院外科、内科以及医学研究中心的研究团队假设在不同过渡状态的巨噬细胞相关的间充质干细胞中,TSG-6的表达可能存在差异。因此,在一项研究中,研究人员希望确定巨噬细胞的哪些转移状态可能参与脂肪干细胞(ASCs)中的TSG-6表达,哪些类型的细胞因子对TSG-6表达很重要,以及哪些信号通路可以调节TSG-6表达。为了探索这些问题,研究了TSG-6在ASCs和M0、M1和M2巨噬细胞间接共培养后的表达以及ASCs中TSG-6表达的最佳条件。此外,针对TSG-6的抗纤维化作用,研究了表达TSG-6的ASCs和巨噬细胞是否能够缓解TGF-β诱导的肝星状细胞纤维化。

与巨噬细胞共培养后 ASCs 中 TSG-6 mRNA 的表达增加
由于MSCs在炎症环境中诱导TSG-6表达,因此研究了MSCs中的TSG-6表达是否因巨噬细胞的转换状态而不同。ASCs单独培养或与巨噬细胞共培养,并分别用IFN-γ和LPS或IL-4和IL-13处理,它们分别促进巨噬细胞向M1或M2表型的转变,然后分析TSG-6表达。结果表明,无论巨噬细胞转化状态如何,都会增加ASCs中的TSG-6表达。M0 和 M2 巨噬细胞分别使 TSG-6 表达增加了 5 倍和 15 倍,而 M1 巨噬细胞显著增加了 ASCs 中的 TSG-6 表达约 62 倍(图1)。这些结果表明,与巨噬细胞共培养增加了ASCs中TSG-6的表达,并且M1巨噬细胞或促炎性条件可能在ASCs的TSG-6表达中起特别重要的作用。
接下来,分析了巨噬细胞是否对ASCs中的TSG-6表达至关重要,以及TSG-6是否在巨噬细胞中表达。ASCs单独培养或与巨噬细胞共培养,并用IFN-γ和LPS(促进M1表型的巨噬细胞转化因子)处理。在用IFN-γ和LPS处理的ASCs中,TSG-6表达增加了约21倍,而与M0巨噬细胞共培养的ASCs中TSG-6表达增加了约10倍。有趣的是,当ASCs与M1巨噬细胞共培养时,ASCs和M1巨噬细胞中的TSG-6 mRNA分别增加了约63倍和46倍。此外,使用小鼠巨噬细胞Raw 264.7分析了巨噬细胞对ASCs中TSG-6 的表达是否是特异性所必需的。结果表明,与由 THP-1 分化的 M1 巨噬细胞类似,用 LPS 处理的 Raw264.7 细胞显著诱导 ASCs 中的 TSG-6 表达。这些结果表明,如果巨噬细胞和间充质干细胞共存于炎症或损伤部位,它们都过度表达TSG-6。
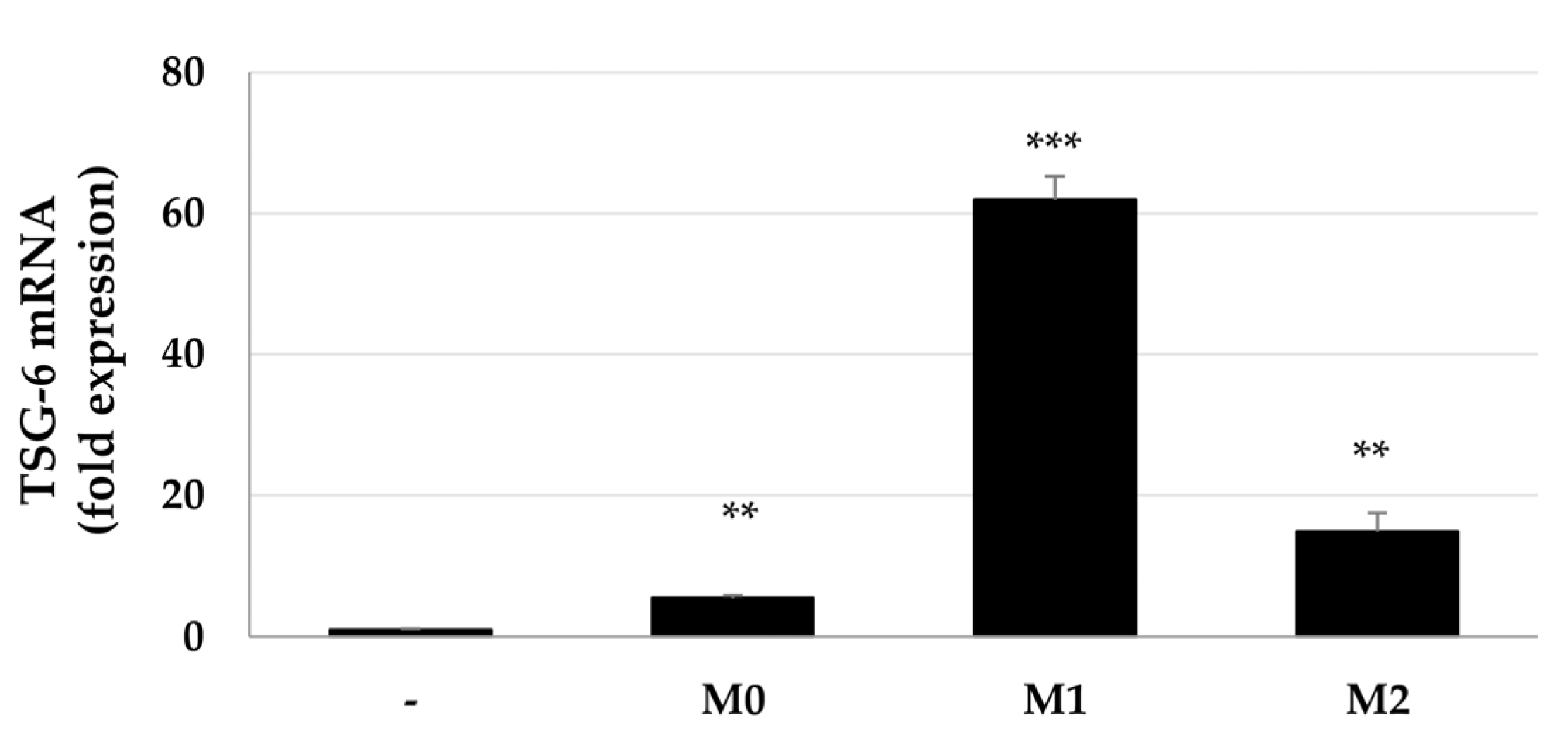
图1 与巨噬细胞间接共培养的ASCs中的TSG-6 mRNA表达。ASCs与巨噬细胞间接共培养2天,并通过qPCR评估TSG-6 mRNA表达。
用细胞因子组合处理的 ASCs 和巨噬细胞中的 TSG-6 表达
由于巨噬细胞分泌的TNF-α和IL-1β可以诱导TSG-6表达,因此实验研究了IFN-γ和LPS、TNF-α或IL-1β是否在ASCs中TSG-6表达的增加中起作用。在用IFN-γ和LPS,TNF-α或IL-1β单独处理的ASCs中,仅在长时间(300秒)后检测到升高的TSG-6水平。然而,在用IFN-γ,LPS和TNF-α联合处理的ASCs中,即使在短时间(22秒)也观察到TSG-6表达显著增加,这种增加取决于TNF-α的剂量(图2 A,lanes 5和6),但不是 IL-1β (图2 A,lanes 7和8)。然而,当用四种因子处理细胞时,观察到最大的TSG-6表达(图2 A,lanes 9 和10)。这些结果表明,几种炎性细胞因子的协同作用是TSG-6在ASCs中最佳表达所必需的。
相比之下,与用IFN-γ和LPS处理的细胞相比,用IFN-γ、LPS和TNF-α组合处理观察到巨噬细胞中的TSG-6表达增加(图2 B,lanes 5)。这些结果表明,诱导TSG-6表达的条件因细胞类型而异,并且ASCs可以通过比巨噬细胞更敏感地对炎症条件做出反应来表达TSG-6。

图2 TSG-6在用TNF-α,IL-1β和/或IFN-γ + LPS处理的ASCs和巨噬细胞中的表达。用不同浓度的TNF-α、IL-1β和/或IFN-γ(20 ng/mL)+ LPS(10pg/mL)处理ASCs或巨噬细胞48 h,采用免疫印迹法检测细胞裂解物和培养上清液中TSG-6表达。(A) ASCs中的TSG-6表达。(B)巨噬细胞中的TSG-6表达。
TSG-6 表达的信号转导者和转录激活者(STAT)信号通路的激活
接下来,研究了由IFN-γ和LPS激活的STAT通路是否参与TSG-6表达。
在ASCs和巨噬细胞中,IFN-γ + LPS处理,但不是TNF-α或IL-1β处理,诱导STAT1/3在15分钟磷酸化。抑制STAT活性的Janus激酶(JAK)抑制剂降低了细胞因子联合处理诱导的TSG-6表达(图3 A)。此外,在间接共培养的ASCs和巨噬细胞中也观察到TSG-6表达的降低(图3 B、C)。这些结果表明,STAT信号通路诱导ASCs和巨噬细胞中的TSG-6表达。此外,STAT活性诱导了TNF-α + IL-1β处理过程中TSG-6的协同表达。
总之,IFN-γ + LPS、TNF-α或IL-1β可以在ASCs和巨噬细胞中诱导TSG-6表达,当ASCs和巨噬细胞在STAT激活条件下暴露于TNF-α或IL-1β时,可能会出现TSG-6过表达。

图3 JAK抑制剂抑制TSG-6表达。在细胞因子处理或共培养前20分钟用JAK抑制剂(JAK1和JAK2抑制剂各10μM)处理细胞。刺激后48 h回收细胞裂解物,并使用免疫印迹分析TSG-6表达。(A)用TNF-α,IL-1β和/或IFN-γ + LPS处理后ASCs中的TSG-6表达。共培养后ASCs(B)或巨噬细胞(C)中的TSG-6表达。
TSG-6 在 ASCs 和巨噬细胞中表达的抗纤维化作用
TSG-6除了具有代表性的抗炎特性外,还可通过调节TGF-β/Smad通路来调节纤维化。因此,实验研究了ASCs和巨噬细胞表达的TSG-6是否可以调节TGF-β诱导的LX-2(人肝星状细胞)细胞的纤维化过程。
在LX-2细胞中,TGF-β诱导Smad3磷酸化和α-SMA表达,TSG-6显著降低了这些表达(图4 A、B)。此外,TGF-β诱导的α-SMA表达在与ASCs和巨噬细胞间接共培养的LX-2细胞中显著降低。
接下来,为了确定LX-2中α-SMA表达的降低是否依赖于ASCs和巨噬细胞表达的TSG-6,使用siRNA研究了TSG-6沉默后α-SMA的表达。结果表明,TSG-6 siRNA 处理的 ASCs 和 Raw 264.7 巨噬细胞中 TSG-6 表达显著降低,导致TGF-β暴露的LX-2细胞中α-SMA表达的恢复。
这些结果表明,TSG-6可以通过抑制LX-2细胞中的Smad3磷酸化来降低α-SMA表达,ASCs和巨噬细胞表达的TSG-6调节LX-2细胞的纤维化活性。

图4 TSG-6在TGF-β处理的LX-2细胞中的抗纤维化作用。
(A)TSG-6在TGF-β处理的LX-2细胞中抑制α-SMA表达。(B)TSG-6抑制Smad3磷酸化。下室中的LX-2细胞与接种在上室的ASCs和巨噬细胞共培养。抑制α-SMA的表达在与ASCs和巨噬细胞共培养的LX-2细胞中(C)或ASCs和RAW 264.7巨噬细胞中(D)。
这些研究结果表明,通过激活STAT1/3增加TSG-6表达,全面的炎症微环境可能在确定ASCs的治疗特性方面发挥重要作用。总之,考虑MSC移植过程中的炎症环境对于增强MSCs和巨噬细胞表达的TSG-6的抗炎和抗纤维化特性非常重要。
参考文献:Gong SC, Yoon Y, Jung PY, Kim MY, Baik SK, Ryu H, Eom YW. Antifibrotic TSG-6 Expression Is Synergistically Increased in Both Cells during Coculture of Mesenchymal Stem Cells and Macrophages via the JAK/STAT Signaling Pathway. Int J Mol Sci. 2022 Oct 28;23(21):13122. doi: 10.3390/ijms232113122. PMID: 36361907; PMCID: PMC9656625.
原文链接:https://pubmed.ncbi.nlm.nih.gov/36361907/
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。
微信搜索公众号“Naturethink”,了解更多细胞体外仿生培养技术及应用

新鲁汶大学的公报指出,如今抗生素耐药菌的出现给人类和医药带来了新 ...

根据“生物安全关键技术研发”重点专项评审工作安排,生物中心将于2 ...

为更好的向用户、潜在用户提供我们的产品,即日起推出如下活动:凡向 ...

2018年度国家科学技术奖提名工作已结束,国家科学技术奖励工作办 ...

据英国《自然·通讯》杂志日前发表的一篇医学论文报告,科学家发现了 ...

Naturethink祝愿伟大祖国繁荣昌盛,欣欣向荣! ...

“免疫系统在高血压中扮演了未曾预料的重要角色。”英国格拉斯哥大学 ...

“来一场中国制造的品质革命!”3月5日,李克强总理在政府工作报告 ...

我司自主研发产品,重视知识产权,已拥有多项专利证书! ...

美国侨报网近日刊文称,一项新出炉的研究警告称,即使是失眠一夜,也 ...
公司完成细胞张应变与压力综合培养仪器的研发; ...

Naturethink网站及微信内容逐步完善,敬请查阅! ...

为提高区域自主创新能力,推进区域科技创新体系建设,加大创新驱动区 ...

2018年春节将至,我司放假时间安排为:2月14日至2月21日, ...

澳大利亚和英国一项研究显示,对于几乎任何年龄段的人群而言,快走都 ...

2018年国家自然科学基金项目申请工作已开始,你准备好了吗? ...
壁面剪切应力(WSS),是单位面积上由血管表面流动的液体产生的接 ...
癌症在促进肿瘤表型表观遗传重编程和修饰的复杂组织微环境中发展。此 ...