壁面剪切应力(WSS),是单位面积上由血管表面流动的液体产生的接近管壁的切向摩擦力,已在多项研究中证明会影响动脉瘤的形成和破裂。WSS 的血流动力学因素如何影响动脉瘤的自然病程一直是争论的主题。高 WSS 与低 WSS 都与动脉瘤的生长有关,动脉瘤壁组织可能同时遇到高低 WSS,但只有少数动脉瘤破裂。因此,血管壁对施加在其上的应力变化的反应所固有的因素必然会影响破裂的风险。美国辛辛那提大学医学中心神经病学课题组的一项研究讨论了动脉瘤壁遇到的血流动力学力(即 WSS)如何与管壁中的组织变化相关,以及这些组织变化如何与动脉瘤的生长和破裂相关。 编辑搜图血管壁内有三层:内膜、中膜和外膜。最内层,即内膜,由血管腔侧的单层内皮细胞(ECs)组成,并与血流直接接触。中膜包含平滑肌细胞(SMCs)和胶原蛋白(主要是 III 型)。外膜,即外层,由 I 型胶原蛋白、弹性蛋白、成纤维细胞、神经和血管组成。动脉瘤壁结构显示血管壁组织学的改变:内部弹性层(IEL)的变性、中膜变薄和 ECM 退化。受损血管壁的脆弱性与破裂的风险有关。正常血管壁如何转化为动脉瘤是多方面的,但由机械刺激(如 WSS)引发的细胞水平变化似乎在动脉瘤的进展中起关键作用。接下来将讨论在动脉瘤中发现的与剪切应力相关的组织学变化,以及这些变化如何导致动脉瘤生长和破裂。内皮功能由正常 WSS(1.5-2.5 Pa)调节。WSS 可以根据血液的速度和粘度而增加和减少。然后根据血管中的流动模式,随着血流速度的增加或减少而产生 WSS 程度的梯度(WSS 梯度-WSSG)。WSSG 定义为 WSS 沿流动方向的空间导数,是沿着血管长度的 WSS 变化。加速流动产生正的 WSSG,而减速流动产生负的 WSSG。动脉瘤壁组织经历的流动模式是复杂的,并且可能在整个动脉瘤的历史过程中发生变化。动脉瘤泡形成过程中所经历的高 WSS 可能随着动脉瘤几何形状的改变而向低 WSS 发展。高、低 WSS 均与动脉瘤生长和破裂有关。在 Jou 等人的一项研究中,破裂和未破裂动脉瘤的平均 WSS 没有统计学差异。然而,在遇到低 WSS 的动脉瘤壁区域中,破裂和未破裂的动脉瘤的暴露面积存在显著差异,破裂的动脉瘤中暴露于低 WSS 的区域比未破裂的动脉瘤更大。此外,Boussel 等人证明动脉瘤生长更可能发生在内皮暴露于低 WSS 的区域。剪切应力的变化也可能在血管壁转变中起作用:Doddasomayajula 等已经证明在动脉瘤破裂患者中,高 WSS 振荡与破裂有关。与未破裂的动脉瘤相比,这些破裂的动脉瘤被发现具有更大的最大剪切应力和更低的最小剪切应力。Dolan 等人已发现 WSS 的梯度对血管壁细胞有影响,已经证明负 WSSG 可能会拮抗高 WSS 对基因表达的影响。内皮损伤被认为是动脉瘤形成的起始因素之一。剪切应力被认为是 ECs 在新血管发育中的重要驱动力。EC 上的层流剪切应力促进细胞周期在 G1或 G0 中的停滞。然而,受干扰的剪切应力会加速 EC 周转,而低剪切应力有利于细胞凋亡。与未破裂动脉瘤相比,已破裂动脉瘤壁的细胞凋亡增加。此外,低 WSS 会促进内皮组织的紊乱并改变 ECs 的分泌模式,导致血管收缩剂和炎症剂的产生增加,而血管扩张剂和抗氧化剂减少。低 WSS 还促进选择素介导的白细胞滚动,已发现淋巴细胞在动脉瘤的形成和破裂中很重要。根据 Sawyer 等人的研究,在颅内动脉瘤诱导方案后 2 周,与野生型小鼠相比,淋巴细胞缺陷小鼠(RAG-1)的颅内动脉瘤显著减少。由分子传感器(如整合素和/或 ECs 上的机械敏感离子通道)感知的慢性高 WSS 会导致基质金属蛋白酶(MMP)的产生,导致血管壁中的 ECM 变性,从而导致管腔扩张以及内皮生长因子的产生增加。随着血管直径的增加,WSS 降低,基质降解刺激也减少。ECs 还通过产生一氧化氮(NO)和前列腺素(特别是作为血管扩张剂的PGI 2 )与 SMCs 相互作用。随着 ECs 持续受损,NO 合酶会因 WSS 升高而减少。在低 WSS 条件下,PGI 2 的产量减少,导致动脉瘤的动脉粥样硬化变化,以及由于氧化酶活性增加和超氧化物清除率降低而导致氧化应激增加。动脉瘤壁内增加的动脉粥样硬化与动脉瘤生长和壁退化有关。EC 不仅对 WSS 敏感,而且还受到 WSSG 的影响。根据 Dolan 等人的研究,阳性 WSSG 下调抑制细胞周期和增殖进程的基因,降低抑制细胞凋亡的基因的表达,并下调与炎症相关的基因。他们还证明,负 WSSG(即使在高 WSS 区域)抵消了本应被较高 WSS 上调的基因的上调。在 WSSG 阳性条件下,随着细胞更新率的增加以及细胞凋亡和 ECM 降解的增加,动脉壁可能更容易受到进一步的机械损伤。除非内皮层受损,否则 SMCs 通常不会暴露于 WSS,然而,它们确实会通过收缩、表型变化、增殖或新基质的合成对压力和壁张力的增加作出反应。动脉 SMCs 可以发生表型变化,从收缩型表型转变为促炎/基质重塑表型。SMCs 最初通过从中膜迁移到内膜来响应增加的 WSS,并且响应局部信号,随着 NF-κβ、IL-1β、TNF-α、MMP 和凋亡途径的启动,从收缩表型转变为分泌表型。IL-1β 在小鼠动脉瘤形成的早期被诱导并定位于SMC,其活性促进 SMC 的凋亡。与对照小鼠相比,IL-1β 敲除小鼠的动脉瘤形成率没有显著差异,但在动脉瘤顶中发现的晚期动脉瘤和细胞凋亡率确实较低,这表明 IL-1β 可能在动脉瘤的进展中很重要。巨噬细胞产生 MMP-2 和 MMP-9,有助于 ECM 的降解。在 Mandelbaum 等人的一项研究中,发现 SMCs 对动脉瘤诱导的血流动力学变化具有促炎反应。此外,巨噬细胞耗竭并没有减少动脉瘤变化的发生。在血流诱导损伤区域,SMCs 的正常收缩表型发生变化,SMA(平滑肌标志物)和钙调蛋白的表达降低,炎症标志物(NF-κB 和 MCP-1)的表达增加。当暴露于剪切应力时,血小板源生长因子(PDGF)和成纤维细胞因子(FGF-2)从 SMCs 中释放出来。PDGF 影响 SMC 迁移和细胞粘附,降低 SMA 表达,并导致 ECM 结构密度降低。Frösen 等人证明 TGF-β、PDGF 和 VEGF 受体在破裂的动脉瘤中上调,并与动脉瘤壁重塑相关。已发现组织型纤溶酶原激活剂(tPA)和人蛋白酶激活受体-1(PAR-1)的产生在高 WSS 下增加,在低 WSS 下减少。此外,Frösen 等人发现剪切应力会影响 SMC 的排列,其排列差异基于均匀和非均匀剪切应力。
编辑搜图血管壁内有三层:内膜、中膜和外膜。最内层,即内膜,由血管腔侧的单层内皮细胞(ECs)组成,并与血流直接接触。中膜包含平滑肌细胞(SMCs)和胶原蛋白(主要是 III 型)。外膜,即外层,由 I 型胶原蛋白、弹性蛋白、成纤维细胞、神经和血管组成。动脉瘤壁结构显示血管壁组织学的改变:内部弹性层(IEL)的变性、中膜变薄和 ECM 退化。受损血管壁的脆弱性与破裂的风险有关。正常血管壁如何转化为动脉瘤是多方面的,但由机械刺激(如 WSS)引发的细胞水平变化似乎在动脉瘤的进展中起关键作用。接下来将讨论在动脉瘤中发现的与剪切应力相关的组织学变化,以及这些变化如何导致动脉瘤生长和破裂。内皮功能由正常 WSS(1.5-2.5 Pa)调节。WSS 可以根据血液的速度和粘度而增加和减少。然后根据血管中的流动模式,随着血流速度的增加或减少而产生 WSS 程度的梯度(WSS 梯度-WSSG)。WSSG 定义为 WSS 沿流动方向的空间导数,是沿着血管长度的 WSS 变化。加速流动产生正的 WSSG,而减速流动产生负的 WSSG。动脉瘤壁组织经历的流动模式是复杂的,并且可能在整个动脉瘤的历史过程中发生变化。动脉瘤泡形成过程中所经历的高 WSS 可能随着动脉瘤几何形状的改变而向低 WSS 发展。高、低 WSS 均与动脉瘤生长和破裂有关。在 Jou 等人的一项研究中,破裂和未破裂动脉瘤的平均 WSS 没有统计学差异。然而,在遇到低 WSS 的动脉瘤壁区域中,破裂和未破裂的动脉瘤的暴露面积存在显著差异,破裂的动脉瘤中暴露于低 WSS 的区域比未破裂的动脉瘤更大。此外,Boussel 等人证明动脉瘤生长更可能发生在内皮暴露于低 WSS 的区域。剪切应力的变化也可能在血管壁转变中起作用:Doddasomayajula 等已经证明在动脉瘤破裂患者中,高 WSS 振荡与破裂有关。与未破裂的动脉瘤相比,这些破裂的动脉瘤被发现具有更大的最大剪切应力和更低的最小剪切应力。Dolan 等人已发现 WSS 的梯度对血管壁细胞有影响,已经证明负 WSSG 可能会拮抗高 WSS 对基因表达的影响。内皮损伤被认为是动脉瘤形成的起始因素之一。剪切应力被认为是 ECs 在新血管发育中的重要驱动力。EC 上的层流剪切应力促进细胞周期在 G1或 G0 中的停滞。然而,受干扰的剪切应力会加速 EC 周转,而低剪切应力有利于细胞凋亡。与未破裂动脉瘤相比,已破裂动脉瘤壁的细胞凋亡增加。此外,低 WSS 会促进内皮组织的紊乱并改变 ECs 的分泌模式,导致血管收缩剂和炎症剂的产生增加,而血管扩张剂和抗氧化剂减少。低 WSS 还促进选择素介导的白细胞滚动,已发现淋巴细胞在动脉瘤的形成和破裂中很重要。根据 Sawyer 等人的研究,在颅内动脉瘤诱导方案后 2 周,与野生型小鼠相比,淋巴细胞缺陷小鼠(RAG-1)的颅内动脉瘤显著减少。由分子传感器(如整合素和/或 ECs 上的机械敏感离子通道)感知的慢性高 WSS 会导致基质金属蛋白酶(MMP)的产生,导致血管壁中的 ECM 变性,从而导致管腔扩张以及内皮生长因子的产生增加。随着血管直径的增加,WSS 降低,基质降解刺激也减少。ECs 还通过产生一氧化氮(NO)和前列腺素(特别是作为血管扩张剂的PGI 2 )与 SMCs 相互作用。随着 ECs 持续受损,NO 合酶会因 WSS 升高而减少。在低 WSS 条件下,PGI 2 的产量减少,导致动脉瘤的动脉粥样硬化变化,以及由于氧化酶活性增加和超氧化物清除率降低而导致氧化应激增加。动脉瘤壁内增加的动脉粥样硬化与动脉瘤生长和壁退化有关。EC 不仅对 WSS 敏感,而且还受到 WSSG 的影响。根据 Dolan 等人的研究,阳性 WSSG 下调抑制细胞周期和增殖进程的基因,降低抑制细胞凋亡的基因的表达,并下调与炎症相关的基因。他们还证明,负 WSSG(即使在高 WSS 区域)抵消了本应被较高 WSS 上调的基因的上调。在 WSSG 阳性条件下,随着细胞更新率的增加以及细胞凋亡和 ECM 降解的增加,动脉壁可能更容易受到进一步的机械损伤。除非内皮层受损,否则 SMCs 通常不会暴露于 WSS,然而,它们确实会通过收缩、表型变化、增殖或新基质的合成对压力和壁张力的增加作出反应。动脉 SMCs 可以发生表型变化,从收缩型表型转变为促炎/基质重塑表型。SMCs 最初通过从中膜迁移到内膜来响应增加的 WSS,并且响应局部信号,随着 NF-κβ、IL-1β、TNF-α、MMP 和凋亡途径的启动,从收缩表型转变为分泌表型。IL-1β 在小鼠动脉瘤形成的早期被诱导并定位于SMC,其活性促进 SMC 的凋亡。与对照小鼠相比,IL-1β 敲除小鼠的动脉瘤形成率没有显著差异,但在动脉瘤顶中发现的晚期动脉瘤和细胞凋亡率确实较低,这表明 IL-1β 可能在动脉瘤的进展中很重要。巨噬细胞产生 MMP-2 和 MMP-9,有助于 ECM 的降解。在 Mandelbaum 等人的一项研究中,发现 SMCs 对动脉瘤诱导的血流动力学变化具有促炎反应。此外,巨噬细胞耗竭并没有减少动脉瘤变化的发生。在血流诱导损伤区域,SMCs 的正常收缩表型发生变化,SMA(平滑肌标志物)和钙调蛋白的表达降低,炎症标志物(NF-κB 和 MCP-1)的表达增加。当暴露于剪切应力时,血小板源生长因子(PDGF)和成纤维细胞因子(FGF-2)从 SMCs 中释放出来。PDGF 影响 SMC 迁移和细胞粘附,降低 SMA 表达,并导致 ECM 结构密度降低。Frösen 等人证明 TGF-β、PDGF 和 VEGF 受体在破裂的动脉瘤中上调,并与动脉瘤壁重塑相关。已发现组织型纤溶酶原激活剂(tPA)和人蛋白酶激活受体-1(PAR-1)的产生在高 WSS 下增加,在低 WSS 下减少。此外,Frösen 等人发现剪切应力会影响 SMC 的排列,其排列差异基于均匀和非均匀剪切应力。 编辑搜图
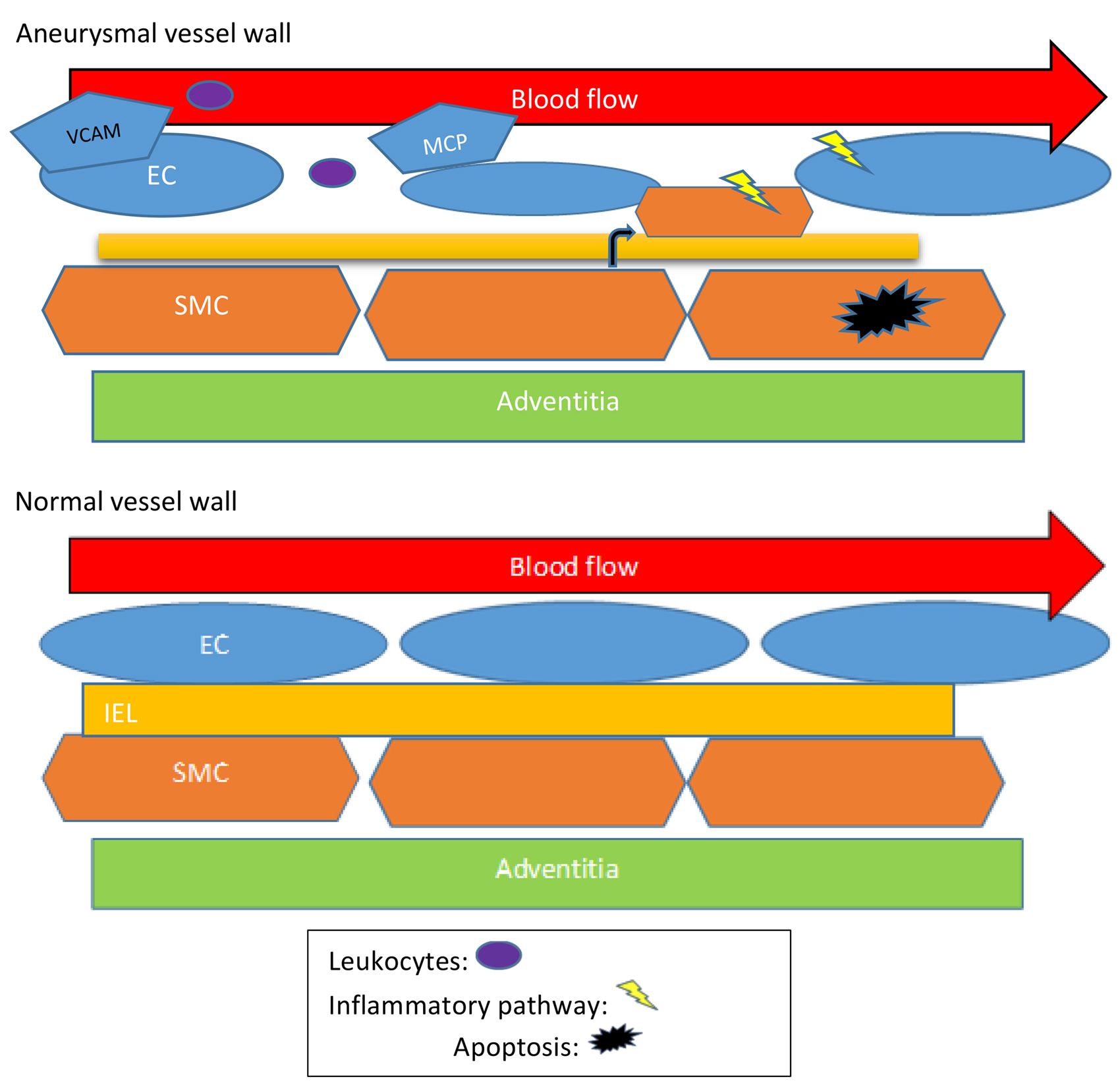
编辑搜图 编辑搜图图1 正常(下)和动脉瘤(上)条件下的血管壁结构。WSS 诱导的血管壁结构变化包括白细胞趋化因子和附着分子(MCPs 和 VCAMs)的产生增加(紫色椭圆),ECs 和 SMCs 中炎症通路的诱导(黄色闪电)。EC 层(蓝色椭圆)随着 ECM 减少和底层 IEL(黄色条)变薄而变得杂乱无章。此外,中膜的 SMCs(橙色六边形)迁移到内膜,表型 SMC 从收缩功能变为分泌功能,随后SMCs 细胞凋亡增加(黑色星形)。
编辑搜图图1 正常(下)和动脉瘤(上)条件下的血管壁结构。WSS 诱导的血管壁结构变化包括白细胞趋化因子和附着分子(MCPs 和 VCAMs)的产生增加(紫色椭圆),ECs 和 SMCs 中炎症通路的诱导(黄色闪电)。EC 层(蓝色椭圆)随着 ECM 减少和底层 IEL(黄色条)变薄而变得杂乱无章。此外,中膜的 SMCs(橙色六边形)迁移到内膜,表型 SMC 从收缩功能变为分泌功能,随后SMCs 细胞凋亡增加(黑色星形)。
导致动脉瘤进展和破裂的动脉瘤壁变化是由高和低剪切应力引起的细胞变化介导的。表1 可以了解基于剪切应力模式的血管壁变化总结,图1 进一步说明了不同模式的剪切应力如何影响动脉瘤血管壁的变化。了解血管壁对WSS的反应是了解导致动脉瘤形成和生长的一系列事件的基础,从而提供可能影响动脉瘤形成的潜在区域,以防止破裂和随之而来的神经系统疾病。
参考文献:Staarmann B, Smith M, Prestigiacomo CJ. Shear stress and aneurysms: a review. Neurosurg Focus. 2019 Jul 1;47(1):E2. doi: 10.3171/2019.4.FOCUS19225. PMID: 31261124.图片来源:所有图片均来源于参考文献
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。
微信搜索公众号“Naturethink”,了解更多关于流体应力刺激细胞培养的知识吧!
 编辑搜图
编辑搜图 编辑搜图
编辑搜图 编辑搜图
编辑搜图