膀胱癌(BCa)是全球诊断出的第 10大癌症,可分为非肌层浸润性膀胱癌和肌层浸润性膀胱癌。根治性膀胱切除术是非转移性肌层浸润性膀胱癌(MIBC)患者的标准治疗方案,无需新辅助化疗,但其复发率和转移率很高。因此,明确膀胱癌进展的机制,寻找膀胱癌治疗的新靶点尤为重要。
最近,免疫疗法已被用于治疗多种癌症,但仍远不能满足临床需求。肿瘤相关巨噬细胞(TAM)是肿瘤微环境(TME)中免疫细胞的主要成分,被认为在肿瘤进展中起核心作用。越来越多的证据表明,TAM可以通过驯化宿主适应性免疫来增加肿瘤细胞的侵袭和转移。有研究认为,对TAM进行肿瘤杀伤能力的再调控可能有助于膀胱癌治疗。因此,迫切需要了解肿瘤进展过程中TAM在膀胱TME中的极化情况。
新出现的证据表明,肿瘤细胞和巨噬细胞之间的通讯在介导TAM极化中起着关键作用。源自肿瘤细胞的信号,如转化生长因子β(TGF-β),可促进未活化的巨噬细胞分化为TAM样免疫抑制表型,其特征是抗炎细胞因子表达增加和促炎细胞因子表达减少。外泌体是细胞分泌的一种细胞外囊泡,其主要成分是磷脂双分子层和携带相关内容,并介导细胞之间的信息传递和物质交换。因此,外泌体有助于TME中肿瘤细胞与其他基质或免疫细胞之间的信息和物质交换。据报道,源自TAM的外泌体可以促进肿瘤细胞的转移以及对化疗的耐药性。相反,膀胱癌细胞T24细胞分泌的外泌体miR-21可以通过激活PI3K-AKT-STAT3信号通路将THP-1细胞来源的巨噬细胞极化为M2表型。然而,肿瘤细胞衍生外泌体介导巨噬细胞极化的潜在机制仍未完全了解。
在郑州大学第一附属医院泌尿外科课题组的一项研究中,曾探讨了膀胱肿瘤细胞衍生的外泌体如何诱导巨噬细胞极化以及对肿瘤生长的影响。实验首先研究了小鼠膀胱细胞MB49来源的外泌体对骨髓来源巨噬细胞(BMDM)极化的影响,以及MB49来源的外泌体刺激巨噬细胞对T细胞增殖的影响,此外还研究了GW4869通过抑制外泌体的产生或释放对膀胱癌生长的潜在治疗功能。具体研究成果以“Cancer derived exosomes induce macrophages immunosuppressive polarization to promote bladder cancer progression”为题发表在 Cell Communication and Signaling volume 期刊。

首先,为研究膀胱癌细胞分泌因子对巨噬细胞极化的影响,采用MB49细胞(小鼠膀胱癌细胞)培养上清液处理小鼠BMDM,分析基因表达。M2相关基因的表达,包括白细胞介素-10(Il-10),Cd206和转化生长因子β(Tgfb)增加,而M1基因 iNOS 表达降低。MB49细胞培养上清液介导的巨噬细胞M2极化通过F4/80+ CD206+ 巨噬细胞群的增加进一步得到验证。这些结果表明,MB49细胞条件培养基(CM)可以促进BMDM向M2表型的极化。
然后研究了MB49细胞CM中的外泌体是否可以介导巨噬细胞M2极化。通过电子显微镜观察外泌体形态(图1 A),并检测了外泌体标志物HSP90和CD63的表达(图1 A)。为了研究巨噬细胞是否可以摄取MB49衍生的外泌体,将BMDM与Cy5.5标记的外泌体进行共培养。免疫荧光和流式细胞分析表明,MB49来源的外泌体可以被巨噬细胞摄取(图1 C、D)。进而通过将Cy5.5标记的MB49衍生外泌体注射到小鼠体内研究了膀胱巨噬细胞中外泌体富集和吸收的可能性。结果显示,膀胱F4/80+ CD11b+ 巨噬细胞中Cy5.5的平均荧光强度远高于对照组(图1 E)。基于上述结果,可以确认源自MB49细胞的外泌体可以在体外和体内被巨噬细胞摄取。

图1 鉴定MB49衍生的外泌体及其在巨噬细胞中的摄取。
接下来,为了进一步鉴定MB49来源外泌体对BMDM表型和功能的影响,检测了MB49来源外泌体处理的BMDM中M1 / M2巨噬细胞标志物的基因表达水平。结果显示,MB49来源的外泌体刺激的BMDM中Il10、Cd206和Tgfb的表达显著增加,而M1巨噬细胞基因 iNOS 的表达降低,这说明MB49来源的外泌体可以将巨噬细胞极化为M2表型。此外,通过利用外泌体抑制剂GW4869来检测M1 / M2巨噬细胞标志物的表达,进一步确认了M2巨噬细胞的极化是外泌体依赖性的。为了进一步研究MB49来源的外泌体极化巨噬细胞的免疫抑制功能,将MB49来源的外泌体刺激的BMDM与CFSE标记的脾脏T细胞共培养3天。MB49衍生的外泌体极化BMDM显著降低了CD4+/CD8+ T 细胞的增殖,而GW4869处理逆转了T细胞增殖的降低。这些结果表明,MB49 CM中的外泌体在将巨噬细胞极化为M2表型和免疫抑制功能中起主导作用。
进一步地,研究人员想知道MB49衍生的外泌体诱导的免疫抑制巨噬细胞是否会影响体内膀胱肿瘤细胞的生长。在建立的小鼠皮下肿瘤模型中,与DMSO处理组相比,GW4869处理组的异种移植肿瘤的肿瘤/体重比和生长速度显著较小且较慢(图2 A-C)。而且,肿瘤中大多数巨噬细胞是M2(F4/80+ CD206+)表型,GW4869处理显著降低了M2巨噬细胞的百分比(图2 D)。此外,GW4869处理组CD4+ 和CD8+ T 细胞的比例显著更高(图2 E)。这些结果表明,MB49来源的外泌体可以通过外泌体介导的免疫抑制TME促进肿瘤细胞的生长。

图2 MB49衍生的外泌体促进肿瘤细胞的生长。
越来越多的证据表明,外泌体miRNA具有多种功能,如促进肿瘤生长、侵袭、调节TME等。最后,为了进一步阐明MB49衍生外泌体中的miRNA谱,进行了微阵列分析。基于MB49衍生的外泌体miRNAs靶基因,通过KEEG分析鉴定出多种癌症相关信号通路,如PI3K-AKT通路。由于PTEN是一种肿瘤抑制因子,并且负调节PI3K-AKT信号,因此鉴定了两种miRNAs,miR-92b-3p和miR-1231-5p,它们可以靶向Pten mRNA位点。
在MB49来源外泌体刺激的BMDM中PTEN的表达降低(图3 A)。因此,p-PI3K和p-AKT显著上调(图3 A)。值得注意的是,p-STAT3/6也在MB49衍生的外泌体刺激后30分钟和1小时被激活,但潜在的机制需要进一步研究。为了进一步证实miR-1231-5p或miR-92b-3p在MB49衍生的外泌体中对PTEN的抑制,分别用miR-1231-5p模拟物或miR-92b-3p模拟物或MB49衍生外泌体的每种抑制剂刺激BMDM。结果观察到,miR-1231-5p模拟物或miR-92b-3p模拟物处理明显降低了PTEN蛋白水平,这与MB49衍生的外泌体刺激相当。同样,miR-1231-5p模拟物或miR-92b-3p模拟物处理增加了p-PI3K/p-AKT/p-STAT3/6 蛋白水平。此外,MB49衍生的外泌体介导的PTEN蛋白下调和p-PI3K/p-AKT/p-STAT3/6上调通过补充miR-1231-5p抑制剂或miR-92b-3p抑制剂逆转(图3 B)。这些数据表明,MB49衍生外泌体中所含的miR-1231-5p 和miR-92b-3p 在激活PTEN/AKT/STAT3/6通路中起关键作用。
基于上述结果,发现MB49来源的外泌体miRNAs可以通过激活PTEN/AKT/STAT3/6通路诱导巨噬细胞极化为免疫抑制表型,从而有助于建立免疫抑制TME以促进肿瘤生长。

图3 MB49衍生的外泌体激活BMDM中的PTEN/AKT/STAT3/6信号通路。
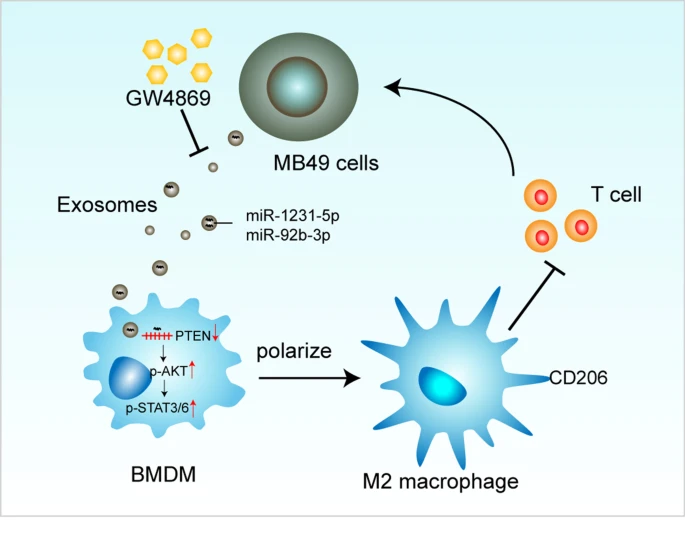
图4 图形概要
MB49来源的外泌体可以被巨噬细胞摄取,从而促进巨噬细胞免疫抑制极化。机制上,MB49衍生的外泌体诱导巨噬细胞M2极化是通过PTEN的下调和AKT/STAT3/6信号的激活介导的。此外,在小鼠皮下肿瘤模型中,GW4869阻碍外泌体的产生或分泌可抑制巨噬细胞向免疫抑制表型和功能的分化,从而抑制肿瘤的生长。
综上所述,该研究进一步证实了膀胱癌细胞来源的外泌体有助于建立免疫抑制性TME并促进肿瘤进展。外泌体miR-92b-3p和miR-1231-5p可能在AKT/STAT3/6信号通路的激活和诱导巨噬细胞免疫抑制分化中起至关重要的作用。此外,GW4869对外泌体的产生或释放的阻碍可以通过逆转免疫抑制TME来抑制膀胱肿瘤细胞的生长。
参考文献:Jiang Z, Zhang Y, Zhang Y, Jia Z, Zhang Z, Yang J. Cancer derived exosomes induce macrophages immunosuppressive polarization to promote bladder cancer progression. Cell Commun Signal. 2021 Sep 14;19(1):93. doi: 10.1186/s12964-021-00768-1. PMID: 34521440; PMCID: PMC8439012.
原文链接:https://pubmed.ncbi.nlm.nih.gov/34521440/
小编旨在分享、学习、交流生物科学等域的研究进展。如有侵权或引文不当请联系小编修正。
微信搜索公众号“Naturethink”,了解更多细胞体外仿生培养技术及应用。

新鲁汶大学的公报指出,如今抗生素耐药菌的出现给人类和医药带来了新 ...

根据“生物安全关键技术研发”重点专项评审工作安排,生物中心将于2 ...

为更好的向用户、潜在用户提供我们的产品,即日起推出如下活动:凡向 ...

2018年度国家科学技术奖提名工作已结束,国家科学技术奖励工作办 ...

据英国《自然·通讯》杂志日前发表的一篇医学论文报告,科学家发现了 ...

Naturethink祝愿伟大祖国繁荣昌盛,欣欣向荣! ...

“免疫系统在高血压中扮演了未曾预料的重要角色。”英国格拉斯哥大学 ...

“来一场中国制造的品质革命!”3月5日,李克强总理在政府工作报告 ...

我司自主研发产品,重视知识产权,已拥有多项专利证书! ...

美国侨报网近日刊文称,一项新出炉的研究警告称,即使是失眠一夜,也 ...
公司完成细胞张应变与压力综合培养仪器的研发; ...

Naturethink网站及微信内容逐步完善,敬请查阅! ...

为提高区域自主创新能力,推进区域科技创新体系建设,加大创新驱动区 ...

2018年春节将至,我司放假时间安排为:2月14日至2月21日, ...

澳大利亚和英国一项研究显示,对于几乎任何年龄段的人群而言,快走都 ...

2018年国家自然科学基金项目申请工作已开始,你准备好了吗? ...
壁面剪切应力(WSS),是单位面积上由血管表面流动的液体产生的接 ...
癌症在促进肿瘤表型表观遗传重编程和修饰的复杂组织微环境中发展。此 ...