研究表明,内皮-间充质转化(EndoMT)参与病理性血管重塑过程。作为内皮细胞的前体细胞,内皮祖细胞(EPCs)EndoMT也是病理性血管重塑的常见机制。此外,振荡剪切应力(OSS)促进了EPC EndoMT。EPCs暴露于OSS后,内皮细胞标志物VE-钙粘蛋白和CD31的表达下调。同时,间充质细胞标志物α-SMA和SM22α的表达显著增加。因此,潍坊医学院基础医学院、淄博市中心医院转化医学中心的一项研究探讨了OSS诱导的EPC EndoMT的机制,以期进一步阐明OSS对EPC EndoMT的影响以及病理性血管重塑的发生和发展。
外泌体(Exos)是具有完整膜结构(直径30-150nm)的纳米级细胞外囊泡,主要负责细胞间的物质运输和信息传递。Exos被认为是细胞-细胞通讯的重要介质,参与许多生理和病理过程。在这项研究中,研究人员发现OSS处理的EPCs释放的Exos(OSS-Exos)可以诱导EPC EndoMT。但内部机制有待进一步探讨。
最近,Exos中的环形RNAs(circRNAs)引起了广泛的关注。CircRNAs具有共价闭环结构。新出现的证据表明,外泌体circRNAs在复杂的人类病理学中起着重要作用。此外,circRNAs可以充当miRNA分子的“海绵”,抑制miRNA与靶基因mRNAs的结合,从而促进靶基因的转录。
该团队使用高通量测序技术研究了暴露于OSS的EPCs中circRNAs的表达谱。基于生物信息学分析和实验验证,发现circ-1199被OSS显著上调并明显加载到Exos中。然而,OSS诱导的EPC EndoMT是否由外泌体circ-1199介导目前尚不清楚。该研究旨在探讨 Exos 和外泌体circ-1199对EPC EndoMT的影响和可能机制。

从 OSS 处理的 EPCs 灌流液中分离的Exos诱导 EPC EndoMT
EPCs分泌的Exos影响血管细胞和组织功能,实验首先确定了Exos是否参与OSS(±3.5 dyne/cm2,1 Hz)诱导的EPC EndoMT。从细胞上清液(Static-Exos)或灌流液(OSS-Exos)中分离Exos。WB揭示了EPCs衍生的Exos表达CD9、CD81和CD63,它们是Exos的代表标志物。
为了评估OSS-Exos对EPC的影响,PKH26标记的Exos与EPCs的共培养,发现这些Exos被EPCs有效地吸收(图1 D)。EdU测定结果表明,OSS-Exos显著增加了EPCs的增殖(图1 E)。RT-qPCR和WB结果显示,OSS-Exos下调内皮标志物CD31和VE-钙粘蛋白的表达,上调间充质细胞标志物α-SMA和SM22α的表达(图1 F、G)。这些数据表明,OSS-Exos在EPCs中诱导了EndoMT。

图1 OSS-Exos诱导EPC增殖和EndoMT。
Circ-1199 在用 OSS 和 OSS-Exos 处理的 EPCs 中显著上调
通过高通量RNA测序筛选用OSS处理的EPCs中表达的circRNAs。如图2 A-B所示,基于生物信息学分析,选择circ-1199作为靶向circRNA。接下来,通过RT-qPCR证实了circ-1199在OSS 加载的EPCs中的表达。结果表明,当EPCs加载OSS持续 3、6、12、24 h时,circ-1199在6 h后增加,并在24 h内保持较高水平(图2 C)。此外,RNA FISH表明EPCs在静态状态下很少表达circ-1199,但在OSS加载后circ-1199阳性细胞数量明显增加(图2 D)。
接下来,进行RT-qPCR和RNA FISH测定以测量Exos中circ-1199的表达。RT-qPCR结果显示,OSS-Exos中circ-1199的水平高于静态-Exos(图2 E)。RNA FISH结果表明,当Exos与EPCs共培养时,OSS-Exos处理的EPCs中circ-1199的表达高于静态-Exos处理的EPCs(图2 F)。

图2 Circ-1199在用OSS处理的EPC中异常表达。
Circ-1199 促进了 EPC EndoMT
为了评估circ-1199对EPC EndoMT的影响,将circ-1199过表达慢病毒载体(LV-circ-1199)转染到EPCs中。结果表明,用LV-circ-1199转染EPCs后,circ-1199的表达明显上调,增殖明显增加。此外,内皮细胞标志物VE-钙粘蛋白和CD31的表达降低,而间充质标志物α-SMA和SM22α的表达在基因和蛋白质水平均上调。这些结果与用OSS-Exos处理的EPCs的结果一致。
Circ-1199–let-7g-5p–HMGA2 ceRNA 参与 EPC EndoMT
新兴研究表明,circRNAs的主要机制是作为miRNA的海绵,从而释放miRNAs对靶基因的抑制作用。然后,实验预测了miRNAs和circRNAs之间的结合位点。结果表明,circ-1199具有两种类型的miRNAs(miR-520f和let-7g-5p)的结合位点,let-7g-5p表现出更多的结合位点。同时,获得了94个靶基因作为let-7g-5p候选基因,其中HMGA2得分最高。双荧光素酶报告基因测定显示,circ-1199有效结合let-7g-5p(图3 C),let-7g-5p也与HMGA2 mRNA的3′UTR结合(图3 D)。RT-qPCR结果表明,circ-1199的过表达降低了let-7g-5p的表达,同时增加了HMGA2的表达(图3 E)。此外,let-7g-5p模拟物(图3 F)和LV-shHMGA2(图3 G)都下调了EPCs中α-SMA和SM22α的表达。
有趣的是,用OSS-Exos处理EPCs后,circ-1199的表达增加(图3 H)。同时,let-7g-5p的表达降低(图3 I),HMGA2显著增加(图3 J)。WB结果证实了HMGA2的上调表达(图3 K)。
这些结果表明,OSS-Exos可以上调circ-1199,从而可能发挥分子“海绵”的作用吸附let-7g-5p,从而增加HMGA2的表达。

图3 Circ-1199–let-7g-5p–HMGA2 ceRNA参与EPC EndoMT。
Circ-1199–let-7g-5p–HMGA2 调节 EPC 转录因子 Smad3 和 Snail
据报道,多种信号通路,如TGF-β/Smad信号、Wnt/β-连环蛋白信号和Notch信号通路,都参与了EndoMT的转录调控。研究表明,HMGA2上调TGF-β/Smad信号通路中Snail、Twist 和Slug 的表达,从而导致上皮细胞中上皮到间充质的转化(EMT)。因此,实验进一步研究了转录因子Smad3和Snail是否参与EPCs的EndoMT过程。WB结果表明,OSS-Exos处理EPCs后,p-Smad3/Smad3和Snail的蛋白表达明显上调。
为了进一步了解OSS-Exos激活EPCs中EndoMT相关转录因子的机制,在用LV-circ-1199,let-7g-5p模拟物或LV-shHMGA2预处理EPCs后测量了HMGA2,p-Smad3 / Smad3和Snail的表达。结果表明,经LV-circ-1199、let-7g-5p模拟物和LV-shHMGA2处理后,HMGA2、p-Smad3/Smad3和Snail 的表达均上调。然而,let-7g-5p模拟物和LV-shHMGA2抑制了EPCs中HMGA2,p-Smad3/Smad3和Snail的表达。
这些结果表明,circ-1199–let-7g-5p–HMGA2参与了EPCs中OSS-Exos诱导的p-Smad3/Smad3和 Snail 的激活。
OSS-Exos 和 circ-1199 在体外和体内都损伤了 EPCs 的血管生成
血管生成能力是EPCs的重要功能。血管生成能力下降是 EPC s中 EndoMT 之后的标志性事件。为了进一步研究OSS-Exos对EPC功能的影响,实验在体外评估了血管生成。结果表明,OSS-Exos组EPC血管生成显著降低(图4 A)。此外,用LV-circ-1199转染后,EPCs的血管生成能力也明显降低(图4 B)。
接下来,使用Matrigel plug 测定法来测定小鼠体内EPCs的血管生成。结果表明,用OSS-Exos处理的EPCs形成较少的血管样结构(图4 C)。此外,在OSS-Exos处理的EPCs中,CD31和vWF的表达降低(图4 D),α-SMA和SM22α的表达增加(图4 E)。
此外,与对照组相比,用LV-circ-1199处理EPCs后,血管状结构的数量减少(图4 F)。同时,内皮标志物CD31和vWF的表达降低(图4 G),但间充质标志物α-SMA和SM22α的表达明显增加(图4 H)。

图4 OSS-Exos和circ-1199在体外和体内都损害了EPCs的血管生成。
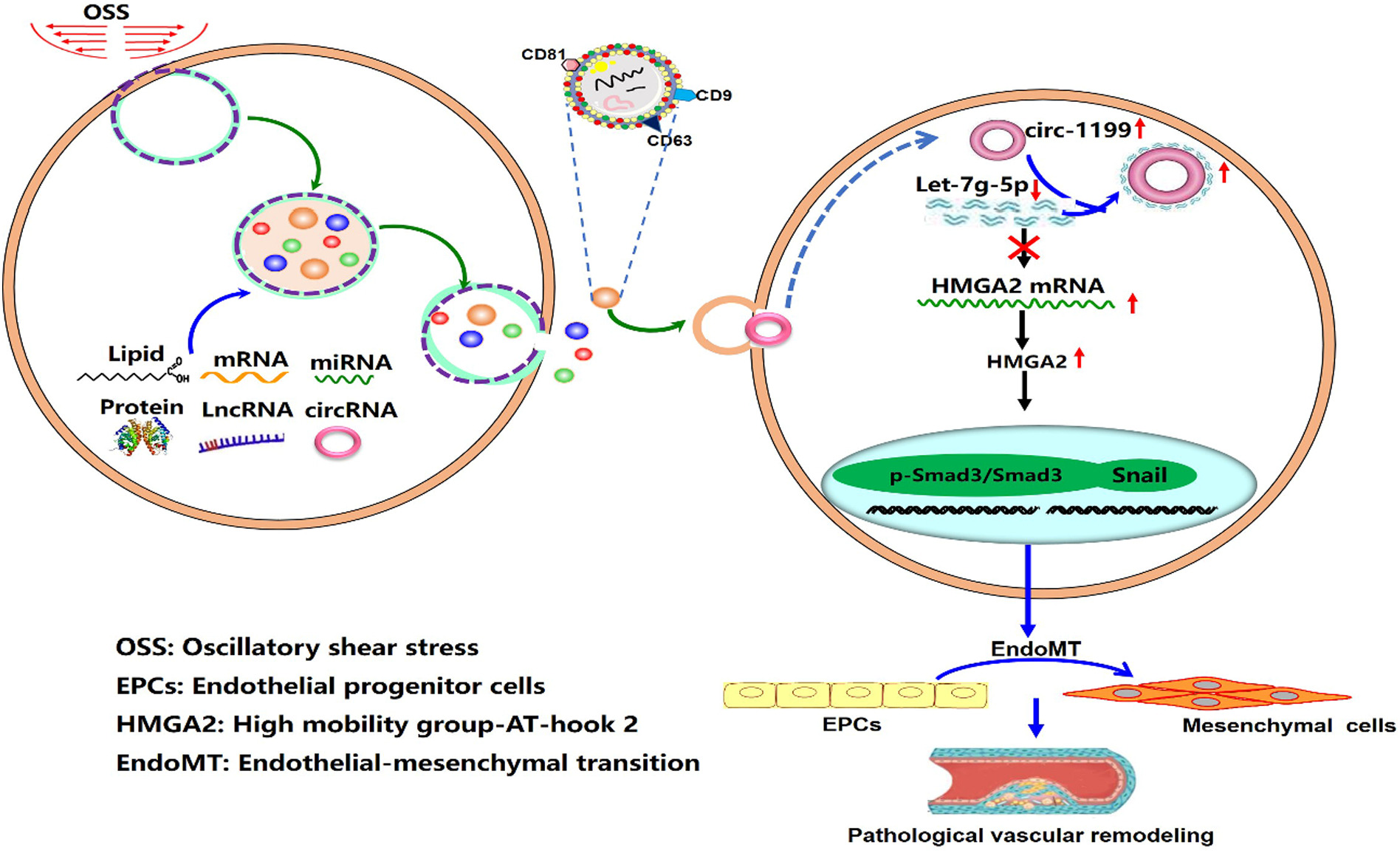
图5 在Exos circ-1199处理后 EPC EndoMT的机制。
综上所述,在OSS-Exos中富集的circ-1199促进EPC EndoMT并作为let-7g-5p的分子海绵,从而上调HMGA2的表达。然后p-Smad3/Smad3/Snail 可能参与这个过程(图5)。
参考文献:Li L, Wen J, Li H, He Y, Cui X, Zhang X, Guan X, Li Z, Cheng M. Exosomal circ-1199 derived from EPCs exposed to oscillating shear stress acts as a sponge of let-7g-5p to promote endothelial-mesenchymal transition of EPCs by increasing HMGA2 expression. Life Sci. 2023 Jan 1;312:121223. doi: 10.1016/j.lfs.2022.121223. Epub 2022 Nov 23. PMID: 36435223.
原文链接:https://pubmed.ncbi.nlm.nih.gov/36435223/
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。
微信搜索公众号“Naturethink”,了解更多细胞体外仿生培养技术及应用。

新鲁汶大学的公报指出,如今抗生素耐药菌的出现给人类和医药带来了新 ...

根据“生物安全关键技术研发”重点专项评审工作安排,生物中心将于2 ...

为更好的向用户、潜在用户提供我们的产品,即日起推出如下活动:凡向 ...

2018年度国家科学技术奖提名工作已结束,国家科学技术奖励工作办 ...

据英国《自然·通讯》杂志日前发表的一篇医学论文报告,科学家发现了 ...

Naturethink祝愿伟大祖国繁荣昌盛,欣欣向荣! ...

“免疫系统在高血压中扮演了未曾预料的重要角色。”英国格拉斯哥大学 ...

“来一场中国制造的品质革命!”3月5日,李克强总理在政府工作报告 ...

我司自主研发产品,重视知识产权,已拥有多项专利证书! ...

美国侨报网近日刊文称,一项新出炉的研究警告称,即使是失眠一夜,也 ...
公司完成细胞张应变与压力综合培养仪器的研发; ...

Naturethink网站及微信内容逐步完善,敬请查阅! ...

为提高区域自主创新能力,推进区域科技创新体系建设,加大创新驱动区 ...

2018年春节将至,我司放假时间安排为:2月14日至2月21日, ...

澳大利亚和英国一项研究显示,对于几乎任何年龄段的人群而言,快走都 ...

2018年国家自然科学基金项目申请工作已开始,你准备好了吗? ...
壁面剪切应力(WSS),是单位面积上由血管表面流动的液体产生的接 ...
癌症在促进肿瘤表型表观遗传重编程和修饰的复杂组织微环境中发展。此 ...