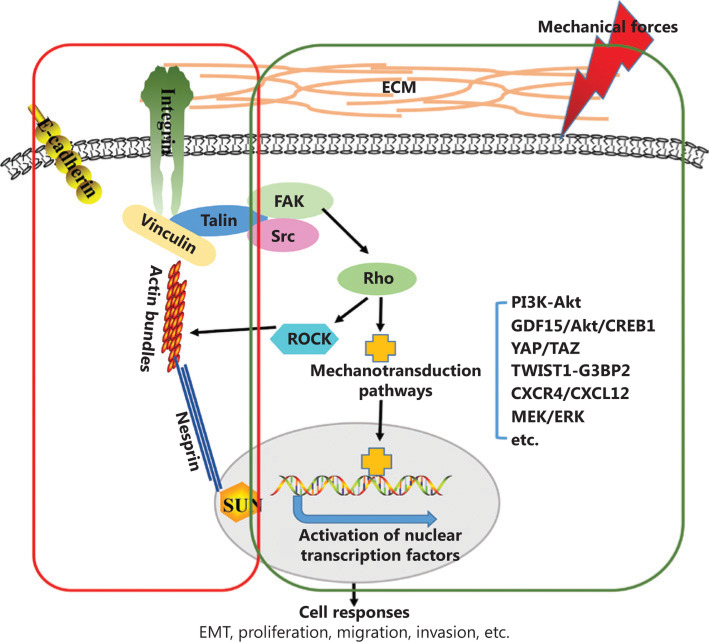
一般来说,腰椎的承受压力过大被认为是退行性椎间盘疾病(DDD)的主要原因。由不良的生活方式或肥胖引起的过度脊柱负荷可导致椎间盘(IVD)细胞外基质(ECM)的代谢紊乱。此外,过度的脊柱负荷会提高促炎基因的表达,例如Cox2,IL-6、IL-8。炎症通常被认为是有害因素,并参与DDD的发作。因此,缓解炎症反应以恢复IVD结构和功能至关重要。作为IVD的重要组成部分,AF(纤维环)可以缓冲脊柱旋转或弯曲引起的力学负荷,并有助于预防NP(髓核)突出。细胞对机械应力的反应是纤维环退变的关键因素。越来越多的证据表明,机械信号在调节AF修复和再生中起着关键作用。
有研究发现,整合素信号通路通过核因子κB(NF-κB)的核易位调控机械转导,表明NF-κB家族的激活状态。NF-κB活化的增加加速了炎症和分解代谢基因的转录,如IL-6,IL-8,Cox2,Adamts4和Adamts5。此外,NF-κB的激活在关节软骨和终板的张力相关的退行性变化中起核心作用,并且在退行性椎间盘中可以观察到NF-κB活性升高。然而,力学刺激如何控制退行性椎间盘中整合素β1表达水平和NF-κB的活性仍在很大程度上尚不清楚。
Cav1(小窝蛋白-1)是胞膜窖(caveolae)的标志性蛋白质,可作为力学传感器响应来自细胞微环境的各种力学刺激。例如,Cav1通过充当力学传感器来感知剪切应力,压力和拉伸应力,从而参与整合素介导的炎症信号通路。此外,在IVD退变过程中,Cav1基因表达和蛋白质水平升高,并且在用 IL-1β 处理的IVD细胞中可以检测到Cav1的高表达,以诱导炎症反应。因此,阐明Cav1、整合素β1和NF-κB在力学负荷诱导的退行性进展中的机械转导的作用,并分析它们之间的关系,对于DDD治疗具有重要意义。
在苏州大学附属第一医院骨科、中国骨科再生医学学组的一项联合研究中,探索了Cav1在AF退变过程中整合素β1和NF-κB信号通路的机械调控中的作用。研究表明,通过适度的力学刺激靶向Cav1和整合素β1介导的NF-κB信号通路失活可以挽救细胞炎症。此外,体内实验表明,适度的应力牵引可修复退变的椎间盘。这些成果为理解适度运动的对退变组织康复治疗提了理论基础。

为了评估应力刺激对AFC(纤维环细胞)行为的影响,实验用单轴循环牵引力(CTS,0.2HZ)处理AFCs,分别使用 0%(Ctrl)、2%、5% 和12% 不同幅度的CTS 持续应用24 h。5% 或12% CTS处理时,细胞形态变为纺锤状。而且用5% CTS处理后S期细胞的百分比显著增加,表明5% CTS的细胞增殖水平高于其他组。此外,5% 的CTS显著促进了AFC的迁移。基于上述结果,5% 的CTS可以被认为是适度的力学刺激,可能有利于细胞生长。相比之下,12% 的CTS对细胞生长有负面影响,因此被认为是过度的力学负荷。
接下来研究了AFCs中ECM相关蛋白(胶原蛋白I,胶原蛋白II和聚集蛋白聚糖)的表达。与静态条件下和2% 或12% CTS下的细胞相比,在5% CTS下AFCs中,胶原蛋白I,胶原蛋白II和聚集蛋白聚糖的表达水平更高(图1)。因此,5% 被认为是CTS控制AFCs合成代谢的适度机械量级。这些结果还表明,适度的力学刺激可以促进ECM的合成,并有可能促进组织的修复和再生。

图1 应力刺激对AFCs基质合成代谢的影响。采用免疫细胞化学法检测不同牵引力条件下AFCs合成代谢基质(胶原蛋白I、胶原II和聚集蛋白聚糖)的表达水平。
鉴于牵引力刺激对AFCs生长和代谢的影响,实验通过评估促炎基因的表达,进一步探讨了CTS 24 h后AFCs的炎症反应。结果表明,在12% CTS的AFCs中,包括Cox2,Tnfa,IL-1b和IL-6在内的促炎基因显著增加。然而,与静态条件相比,5% CTS对AFCs促炎基因的表达没有明显影响(图2 A)。这可能是由于这些促炎基因在静态条件下AFCs中的低表达所致。由于5% CTS有利于细胞生长,推测该水平的力学刺激可以对AFCs产生抗炎作用,因此用IL-1β处理AFCs以诱导急性炎症反应,然后使用5% CTS 刺激。结果表明,5% CTS能够显著逆转IL-1β处理的AFCs中促炎基因的升高表达(图2 B)。这些结果表明,5% 的CTS减弱了IL-1β诱导的炎症反应,但12% 的CTS加剧了这一过程。
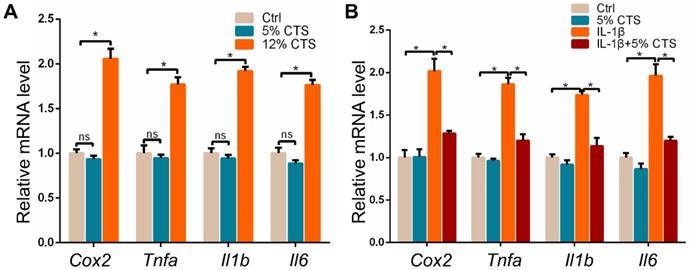
图2 应力刺激对AFCs促炎基因mRNA表达的影响。
(A)不同牵引力加载条件下AFCs中促炎基因(Cox2,Tnfa,IL-1b和IL-6)相对表达的qPCR分析。(B)在存在或不存在IL-1β的情况下,用5% CTS处理的AFCs中促炎基因(Cox2,Tnfa,IL-1b和IL-6)相对表达的qPCR分析。
为了研究不同应力负荷处理的AFCs中基因表达的转录组变化,采用RNA测序来量化AFCs中的mRNA水平。基因表达热图显示,5% CTS组和Ctrl组的表达模式相似,而与 12% CTS组的表达模式差异很大,表明在12% CTS处理下,AFCs发生了显著变化。之后GO和通路富集分析,12% CTS上调的前七个生物过程或通路,其中炎症反应、分解代谢过程和凋亡通路被激活,而细胞增殖呈负调控。具体而言,在12% CTS处理的细胞中发现炎症基因(Ptgs2,IL-6,NFkB1等),力学敏感基因(Cav1,Itgbl1,Itga3等)和分解代谢基因(Mmp17,Mmp3,Timp1等)的显著上调,合成代谢基因(Col2a1,Col11a1,Col14a1等)下调。相反,与对照组相比,5% CTS组的小分子生物合成过程、ECM组织和细胞增殖均上调。热图显示,用5% CTS处理的细胞中合成代谢基因(Col27a1,Col6a3,Col4a4等)上调,表明5% CTS对AFCs有益。
为了阐明CTS诱导的炎症反应背后的机械信号转导机制,在CTS刺激后直接检查了两种力学敏感蛋白Cav1和整合素β1的水平。显然,Cav1和整合素β1的表达在5% CTS组中下调,这可能导致细胞对物理信号的敏感性降低。相比之下,12% CTS显著增加了这两种蛋白质的表达(图3 A、B)。通过免疫荧光检测Cav1蛋白表达的细胞定位。有趣的是,Cav1出现在AFCs的细胞质膜上,并且在CTS为 5% 或12% 时核Cav1 没有进一步增加(图3 C)。同样,整合素β1在静态和机械条件下也位于细胞质膜上(图3 D)。现在,这两种力学敏感蛋白在任何应力刺激条件下总是存在于AFCs的细胞质膜上,它们可能会通过下游的细胞内信号通路将外部力学线索转化为特定的生物信号。p65细胞核易位在调节细胞内促炎反应中起重要作用。根据免疫荧光结果,p65在静态和5% CTS条件下位于细胞质中,但在12% CTS条件下迅速易位到细胞核中(图3 E)。这些数据表明,这两种蛋白质可能参与CTS诱导的AFC炎症反应,其功能可能依赖于p65的细胞核易位。

图3 CTS处理的AFCs中Cav1和整合素β1的表达变化。
(A、B)不同力学条件下AFCs中Cav1和整合素β1蛋白表达的变化。(C-E)不同力学条件下Cav1、整合素β1和p65在AFCs中的定位。
为了确定Cav1参与过度CTS诱导的炎症,使用小干扰RNA(siRNA)双链体来抑制AFCs中的Cav1。结果表明,12% CTS处理的AFCs中敲低Cav1导致促炎基因水平降低。随后过表达Cav1,这增加了p65磷酸化(p-p65)的蛋白质水平。p-p65 是p65活化的指标,并作为NF-κB信号通路的主要转录因子。免疫荧光结果进一步证实,响应Cav1过表达,p65在细胞核中迅速积累。接下来进一步证实Cav1在适度CTS表现出的抗炎效应中的作用,RT-qPCR数据显示,Cav1的过表达消除了5% CTS诱导的抗炎作用,并导致促炎基因的上调。这些数据表明,Cav1可能是一个关键的力学敏感因子,它通过调节p65核易位和下游炎症信号来调节CTS处理的AFCs的炎症反应。
Cav1直接与整合素β1相互作用
先前的研究表明,Cav1和整合素β1之间的相互调控依赖于不同的基质刚度的变化。基于上述结果,研究人员假设Cav1可能在外部力学线索诱导的炎症反应期间连接整合素β1。为了验证假设,首先应用免疫荧光染色来追踪两种蛋白质在转染或不转染pEX4-Cav1和pcDNA3.1-整合素β1质粒的AFCs中的位置。在该实验中,Cav1和整合素β1在AFCs的细胞质中共定位(图4 A)。然后,用pEX4-Cav1或pcDNA3.1-整合素β1质粒转染AFCs,以诱导Cav1或整合素β1过表达。蛋白质印迹测定显示,分别转染pEX4-Cav1或pcDNA3.1-整合素β1质粒的AFCs中整合素β1或Cav1蛋白水平显著上调。根据上述结果,预测这两种力学敏感蛋白之间存在一定的关系。
为了确定Cav1和整合素β1是否直接相互作用,用pEX4-Cav1或pcDNA3.1-整合素β1质粒转染AFCs,然后进行免疫共沉淀(Co-IP)以验证它们的关系。事实上,整合素β1被抗-Cav1抗体沉淀(图4 B),而Cav1也可能被抗-整合素β1抗体沉淀(图4 C)。然而,p65不能被Cav1或整合素β1抗体沉淀,这表明p65核易位受上述力学敏感蛋白间接调控的。这些结果支持,Cav1和整合素β1可以直接相互作用,这两种蛋白质可能在外部力学线索诱导的炎症反应中发挥协同作用。
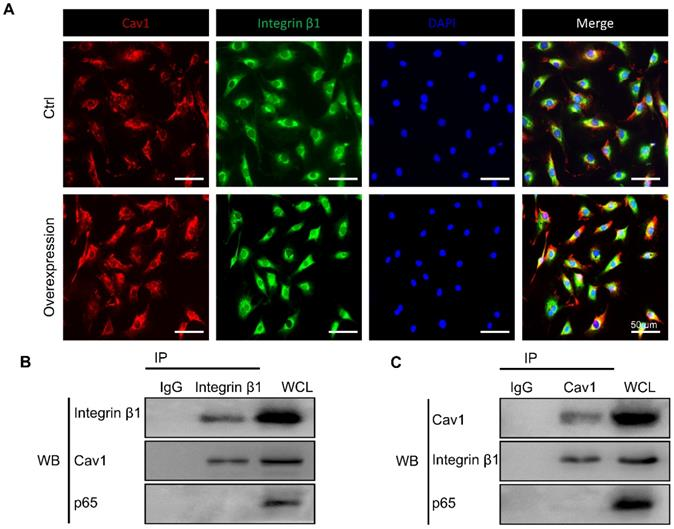
图4 Cav1和整合素β1之间的相互作用。
(A)转染有(过表达组)或不含(Ctrl组)pEX4-Cav1和pcDNA3.1-整合素β3质粒的AFC中Cav1(红色),整合素β1(绿色)和DAPI(蓝色)的免疫荧光图像。在转染有pEX4-Cav1(B)或pcDNA3.1-整合素β1(C)质粒的AFC中进行共Co-IP 测定。
为了进一步研究通过动态牵引力恢复退行性椎间盘的可行性,对轻度椎间盘退变大鼠(压缩处理)的尾椎每隔一天用适度牵引力刺激2小时,持续2周。与假手术组相比,椎间盘高度和 NP 含水量降低。同时分析每组椎间盘的形态变化,AF的胶原纤维排列得波浪状,更多的软骨细胞样细胞出现在AF区域。2周后,NP含水量恢复,动态牵引力后椎间盘的典型形态恢复。总的来说,与释放组的大鼠相比,牵引后的退行性椎间盘显示出更好的恢复。
此外,进行了免疫组织化学染色测定,以分析来自不同组的每个椎间盘AF中Cav1,p-p65,COX-2和胶原蛋白I的表达。数据表明,Cav1,p-p65和COX-2的表达在压缩刺激的椎间盘中上调,但在适度牵引力刺激处理的椎间盘中显著降低。然而,在适度机械刺激处理的椎间盘中,胶原蛋白I的表达呈相反趋势,表达水平较高,代表退行性椎间盘的一种代偿性修复。与体外结果一致,适度的机械刺激可能对退行性椎间盘的修复有益,这可能依赖于 Cav1 介导的信号通路。
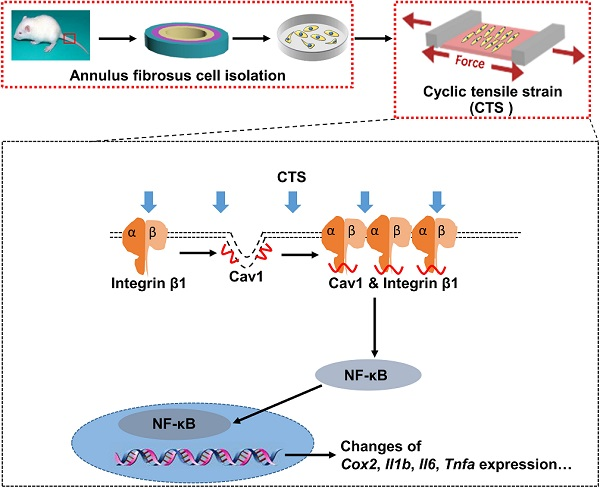
图5 总之,适度的力学刺激抑制了Cav1介导的信号通路,并对AFCs表现出抗炎作用。结合体内结果,阐明了适度应力刺激对椎间盘(IVD)影响的潜在分子机制,可为IVD退变的治疗提供新的治疗策略。
在这项研究中,通过体外和体内模型研究了力学负荷在细胞和组织水平上对椎间盘的影响。研究发现过度的牵引力负荷(12% CTS)抑制了AFC的增殖和迁移,并增加了炎症基因的表达水平。相反,适度机械负荷(5% CTS)通过抑制Cav1介导的整合素β1和NF-κB信号通路来挽救炎症反应并增强AFC增殖,迁移和ECM合成。此外,体内结果表明,适度的力学刺激可以恢复NP的含水量,加速退行性椎间盘的重建。综上所述,这项研究可能会促进理解生理等效刺激对细胞的抗炎作用的进展,并为DDD的物理疗法的创新设计提供可能性。
参考文献:Zhang W, Wang H, Yuan Z, Chu G, Sun H, Yu Z, Liang H, Liu T, Zhou F, Li B. Moderate mechanical stimulation rescues degenerative annulus fibrosus by suppressing caveolin-1 mediated pro-inflammatory signaling pathway. Int J Biol Sci. 2021 Apr 3;17(5):1395-1412. doi: 10.7150/ijbs.57774. PMID: 33867854; PMCID: PMC8040478.
原文链接:https://pubmed.ncbi.nlm.nih.gov/33867854/
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。
微信搜索公众号“Naturethink”,了解更多细胞体外仿生培养技术及应用。

新鲁汶大学的公报指出,如今抗生素耐药菌的出现给人类和医药带来了新 ...

根据“生物安全关键技术研发”重点专项评审工作安排,生物中心将于2 ...

为更好的向用户、潜在用户提供我们的产品,即日起推出如下活动:凡向 ...

2018年度国家科学技术奖提名工作已结束,国家科学技术奖励工作办 ...

据英国《自然·通讯》杂志日前发表的一篇医学论文报告,科学家发现了 ...

Naturethink祝愿伟大祖国繁荣昌盛,欣欣向荣! ...

“免疫系统在高血压中扮演了未曾预料的重要角色。”英国格拉斯哥大学 ...

“来一场中国制造的品质革命!”3月5日,李克强总理在政府工作报告 ...

我司自主研发产品,重视知识产权,已拥有多项专利证书! ...

美国侨报网近日刊文称,一项新出炉的研究警告称,即使是失眠一夜,也 ...
公司完成细胞张应变与压力综合培养仪器的研发; ...

Naturethink网站及微信内容逐步完善,敬请查阅! ...

为提高区域自主创新能力,推进区域科技创新体系建设,加大创新驱动区 ...

2018年春节将至,我司放假时间安排为:2月14日至2月21日, ...

澳大利亚和英国一项研究显示,对于几乎任何年龄段的人群而言,快走都 ...

2018年国家自然科学基金项目申请工作已开始,你准备好了吗? ...
壁面剪切应力(WSS),是单位面积上由血管表面流动的液体产生的接 ...
癌症在促进肿瘤表型表观遗传重编程和修饰的复杂组织微环境中发展。此 ...