内皮细胞(ECs)通过血流不断暴露于流体剪切应力(FSS)。剪切应力通过刺激由 PECAM-1、血管内皮钙粘蛋白(VE-cadherin)和血管内皮生长因子受体2(VEGFR2)组成的机械感觉复合物来调节 EC 功能。此外,一些内皮蛋白或结构,包括细胞-细胞连接分子、整合素、离子通道和细胞骨架,都参与了机械转导。这种机械转导信号是各种内皮功能所必需的,例如增殖、血管生成、迁移、血管舒张和炎症。
柯萨奇病毒和腺病毒受体(CAR)是 B 组柯萨奇病毒和 C 亚组腺病毒的病毒受体,普通存在于心肌细胞表面。心肌中 CAR 表达增加与心肌病相关。在 ECs 中,炎性细胞因子,如肿瘤坏死因子α(TNF-α)和干扰素γ(IFN-γ),下调 CAR 表达和 CAR 介导的中性粒细胞的跨内皮迁移。尽管对 CAR 作为病毒受体的功能已有相当多的了解,但在剪切应力下 CAR 在 ECs 中的表达模式和生理作用仍不清楚。
因此,韩国梨花女子大学医学研究所、生命科学系、中原大学生物医学工程系的课题组的一项研究展示了 CAR 在 FSS 条件下在血管内皮细胞(ECs)中的表达、调控机制和作用。文章名为《Coxsackievirus and adenovirus receptor mediates the responses of endothelial cells to fluid shear stress》。
实验使用单向稳定流(20 dyne/cm2 的剪切应力)用于 LSS 和双向扰动流(±5 dyne/cm2的剪切应力)用于振荡剪切应力(OSS)。在 LSS 和 OSS 之间的交叉实验中,HUVECs 暴露于 LSS 或 OSS 24 小时,然后暴露于其他类型的剪切应力 24 小时。
FSS 调节 ECs 中的 CAR 表达
首先通过测量受到 LSS 或扰动流的 HUVECs 中CAR 表达来研究 FSS 是否调节内皮细胞 CAR 的表达。有趣的是,干扰流上调,而 LSS 下调,CAR 在 mRNA(图1 a)和蛋白质(图1 b)水平上的表达。通过蛋白质印迹检测 CAR 蛋白显示两条条带,一条为约 40 kDa,一条为 46 kDa。实验发现 FSS 模式的变化主要调节 CAR 的表达,由 40 kDa 的条带表示。
为了研究 FSS 对体内内皮 CAR 表达的影响,通过en face 染色评估了自然暴露于各种血流模式的小鼠主动脉组织中的 CAR 的表达。CAR 在扰流的小弯侧(LC)区域的表达高于暴露于 LSS 的胸主动脉(TA)区域。如 z-stack 表面成像所示(图1 c),扰流区域中的 CAR 表达主要位于内皮的管腔表面。
接下来研究了人体动脉组织中的内皮 CAR 表达。与小鼠主动脉组织一致,暴露于干扰流的区域比暴露于正常层流的区域显示出更高水平的 CAR 表达(图1 d)。
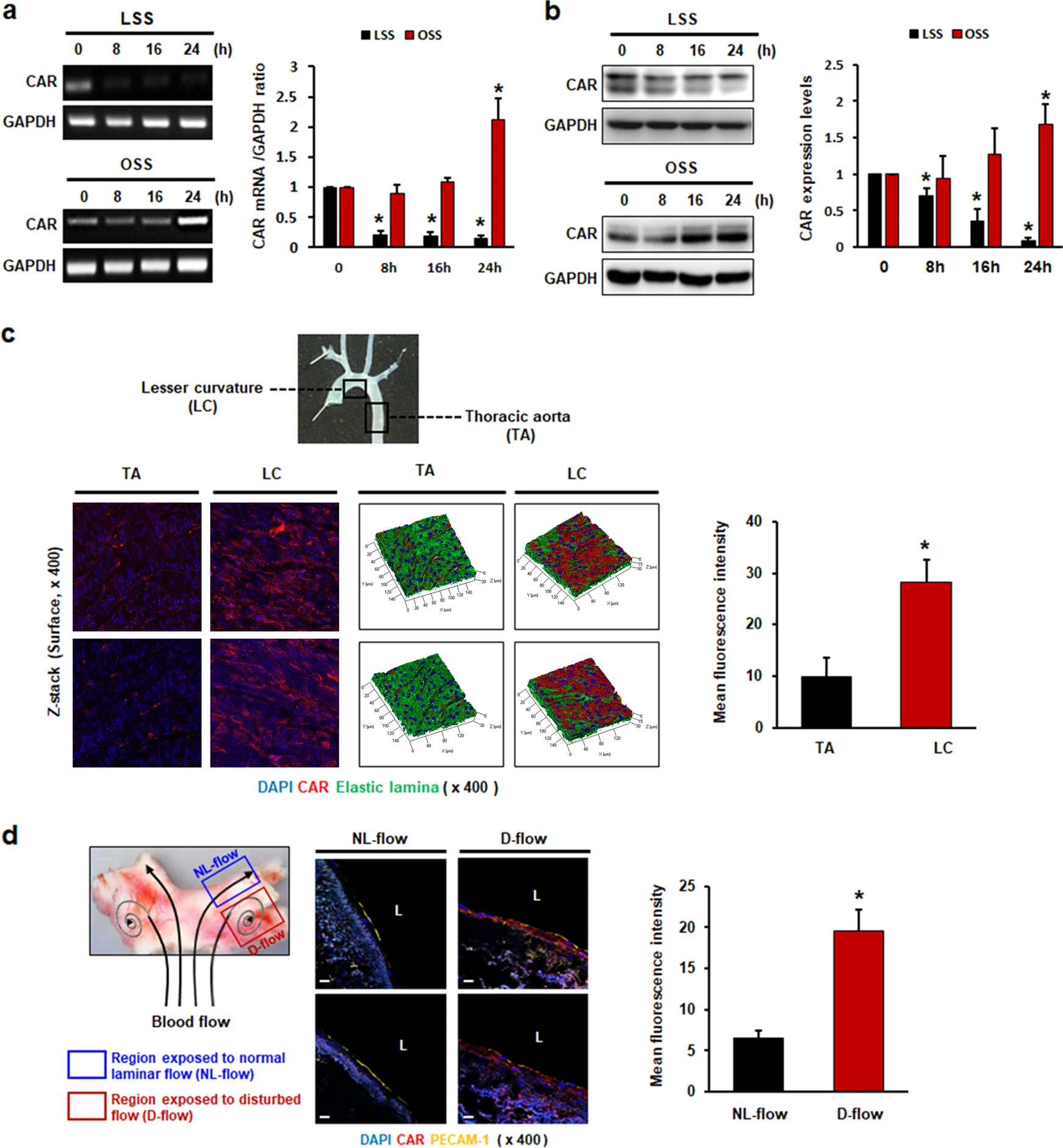
图1 流体剪切应力调节内皮细胞中的 CAR 表达。
HUVECs 在静态、LSS 或 OSS 条件下培养指定的时间段。
(a)通过 RT-PCR 确定编码 CAR 和 GAPDH(内部对照)的 mRNA 水平。
(b) CAR蛋白水平通过蛋白质印迹测量。
(c)根据血管壁剪切应力的分布将小鼠主动脉分为两个区域:小弯侧(LC,扰动流)和胸主动脉(TA,正常层流)。通过en face 染色和共聚焦显微镜评估CAR的表达。
(d)人动脉组织的冷冻切片用抗 PECAM-1 和抗 CAR 抗体染色。PECAM-1 用作内皮特异性标志物。通过共聚焦显微镜比较CAR在具有不同壁剪切应力的血管分叉部位的两个区域中的表达,即外侧扰流(D-Flow)和正常层流内侧(NL-Flow)。
ECs中的CAR表达受流量敏感的KLF2/AP-1轴调节
KLF2 是一种血流响应性关键剪切应力诱导的转录因子,控制许多流量调节的内皮基因的表达。剪切应力处理后,CAR表达与KLF2表达呈负相关(图2 a、b)。因此假设,KLF2 调节 ECs 中的 CAR 表达。为了验证这一假设,评估了转染 KLF2 或编码 KLF2 的质粒的 siRNA 的 HUVECs 中的 CAR 表达。
正如预期的那样,在 LSS 下减少的 CAR 表达在 KLF2 沉默时增加(图2 a)。相反,当 KLF2 过表达时,OSS 下增加的 CAR 表达减少(图2 b)。此外,KLF2 通过抑制 AP-1和核因子kappa B(NF-κB)的激活来下调促炎基因的表达。
为了研究流动条件下 AP-1 是否与 CAR 表达相关,用 AP-1 抑制剂 SR11302 预处理后将 HUVECs 暴露于剪切应力。AP-1抑制降低了OSS中的CAR上调(图2 c)。与这一发现一致,当 AP-1 复合物的成分 c-Jun 和 c-Fos 被沉默时,OSS 下增加的 CAR 表达降低(图2 d )。
接下来检查了 KLF2 对 CAR 的抑制是否由 AP-1 激活阻断介导。为了检测 KLF2 对 AP-1 激活的影响,评估了 KLF2 过表达或敲低后 HUVECs 中 c-Jun 和 c-Fos 的表达。KLF2过表达消除了OSS诱导的c-Jun和c-Fos mRNA水平的增加(图2 e),而LSS条件下的KLF2敲低细胞显示出c-Jun和c-Fos的mRNA水平高于LSS 条件下的细胞(图2 f)。与 LSS 下相比,OSS 始终增强 AP-1 启动子活性。然而,KLF2过表达抑制了OSS诱导的AP-1启动子活性增加(图2 g )。因此,CAR 在 ECs 中的表达受流量响应性 KLF2/AP-1 轴的调节。
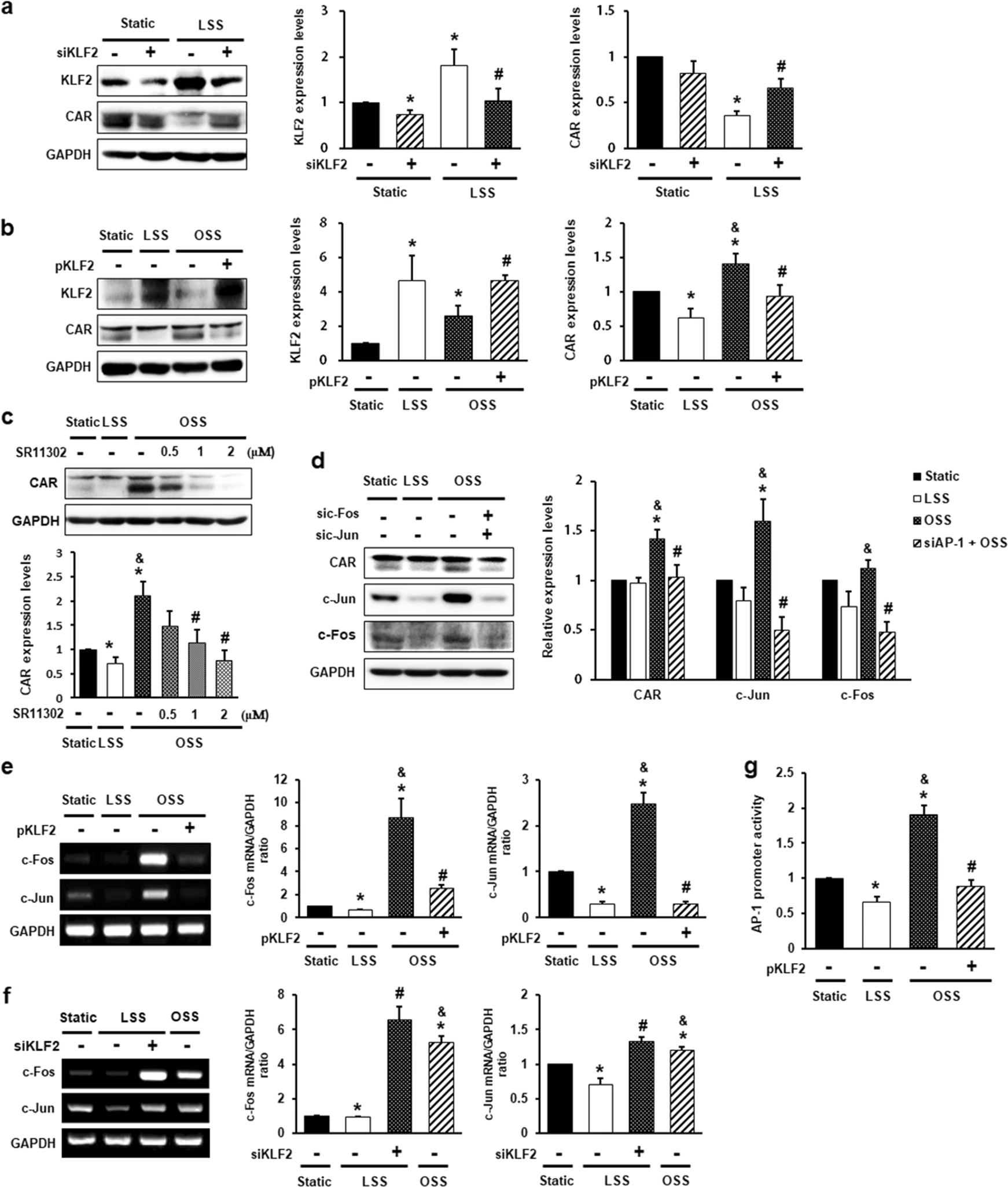
图2 内皮细胞中的 CAR 表达受流量响应性 KLF2-AP-1 轴的调节。
用针对 Krüppel 样因子2(KLF2,50 nM)(a、f)或编码 KLF2(5 μg)(b、e)的质粒的 siRNA 转染 HUVECs,然后暴露于 FSS 4 小时或 24 小时。通过蛋白质印迹测量 KLF2 和 CAR 蛋白水平。
扰流通过激活 NF-κB 通路诱导内皮炎症。NF-κB 的激活是由抑制亚基 IκB 的磷酸化和 NF-κB p65 的核转位介导的。为了探索 CAR 在 ECs 中的作用,确定了 CAR 对扰动流诱导的 NF-κB 活化的影响。IκB 的磷酸化和 NF-κB p65 的核转位在 OSS 中增加,但这种增加被 CAR 敲低抑制(图3 a)。
接下来探讨了 CAR 对 NF-κB 下游信号传导的影响:抗炎 eNOS 基因和促炎基因的表达,例如CAR 敲低的 HUVECs 中血管细胞粘附分子1(VCAM-1)和细胞间粘附分子1(ICAM-1)。eNOS 在 mRNA 处(图3 b )和蛋白质(图3 c)水平上显著下调,而与LSS相比,在OSS下VCAM-1和ICAM-1上调。有趣的是,通过 CAR 敲低,OSS 介导的 eNOS 表达减少升高,而 OSS 下 VCAM-1 和 ICAM-1 水平的增加被 CAR 敲低抑制。
为了评估 CAR 敲低介导的 OSS 诱导的粘附分子水平降低的功能相关性,评估了单核细胞对 HUVECs 的粘附。CAR敲低抑制了OSS诱导的单核细胞对ECs的粘附增加(图3 d)。
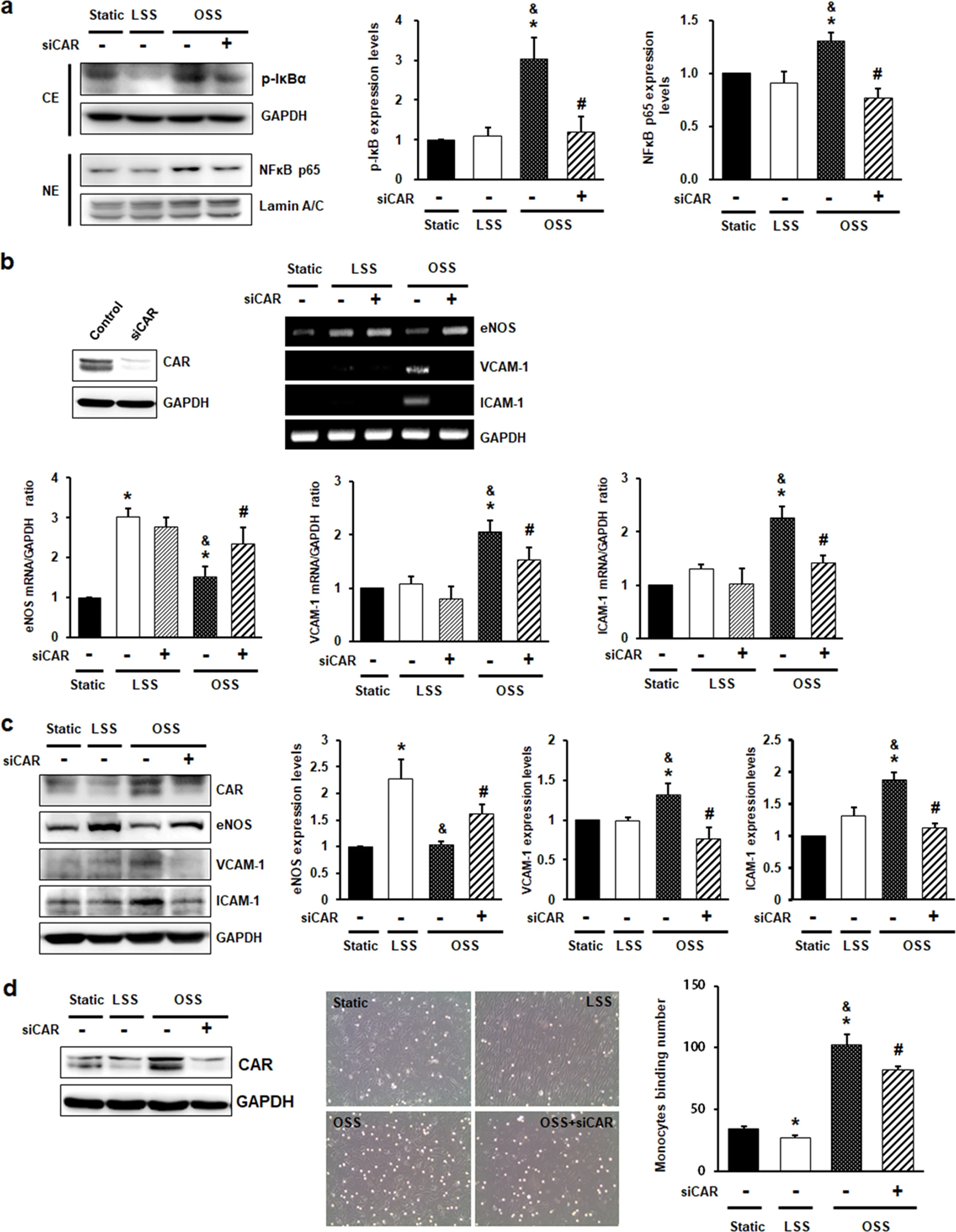
图3 CAR 敲低抑制内皮细胞中受干扰流诱导的炎症反应。
(a)在 FSS 24 小时后分离细胞质和核部分。
(b)通过蛋白质印迹验证 siCAR 对 CAR 的敲低。
(c)通过蛋白质印迹测量 eNOS、VCAM-1 和 ICAM-1 的蛋白质水平。
(d)为了测定单核细胞与内皮细胞的结合,将转染的 HUVECs 暴露于 FSS 24 小时。
CAR缺失对扰流下的致动脉粥样硬化内皮具有保护作用
接下来,通过在 C57BL6 背景上生成 EC 特异性 CAR KO 小鼠并利用部分颈动脉结扎作为干扰流诱导的动脉粥样硬化模型,来确定CAR缺失对体内内皮细胞的影响。在部分颈动脉结扎 3 天后,评估了野生型(WT)和 EC 特异性 CAR KO 小鼠中抗炎基因和促炎基因的表达。从颈动脉内皮中分离出总 RNA,经RT-PCR检测,证实存在内皮特异性标志物(PECAM-1),而不存在平滑肌细胞特异性标志物(α-SMA)。RT-PCR 证实了 ECs 中的有效 CAR KO(图4 a)。
在WT小鼠中,与具有正常层流的未结扎的右颈动脉(RCA)相比,结扎的左颈动脉(LCA)中的CAR表达上调,这与体外实验的结果一致。同样,通过实时 PCR 和免疫组织化学评估,在结扎的 LCA 中,抗炎标志物 eNOS 的水平显著降低,而促炎标志物 VCAM-1 和 ICAM-1 的水平升高。然而,在干扰流下 EC 特异性 CAR KO 小鼠中,没有观察到 VCAM-1 和 ICAM-1 水平的增加。eNOS 表达的减少比在具有结扎 LCA 的 WT 小鼠中观察到的要少(图4 b、c)。
在部分颈动脉结扎和食用西方饮食后 4 周,WT 小鼠的颈动脉粥样硬化的替代标志物—内膜中层厚度(IMT)增加。相比之下,EC 特异性 CAR KO 小鼠的 IMT 降低(图4 d)。此外,比较了人体动脉组织正常和动脉粥样硬化区域的内皮 CAR 表达。正如预期的那样,动脉粥样硬化斑块区域的CAR表达水平高于正常动脉区域(图4 e)。
总之,结果表明,CAR 缺失通过阻断暴露于干扰血流的 ECs 中的炎症反应发挥抗动脉粥样硬化作用,并且 CAR 在颈动脉结扎后观察到的 IMT 增加中起重要作用。
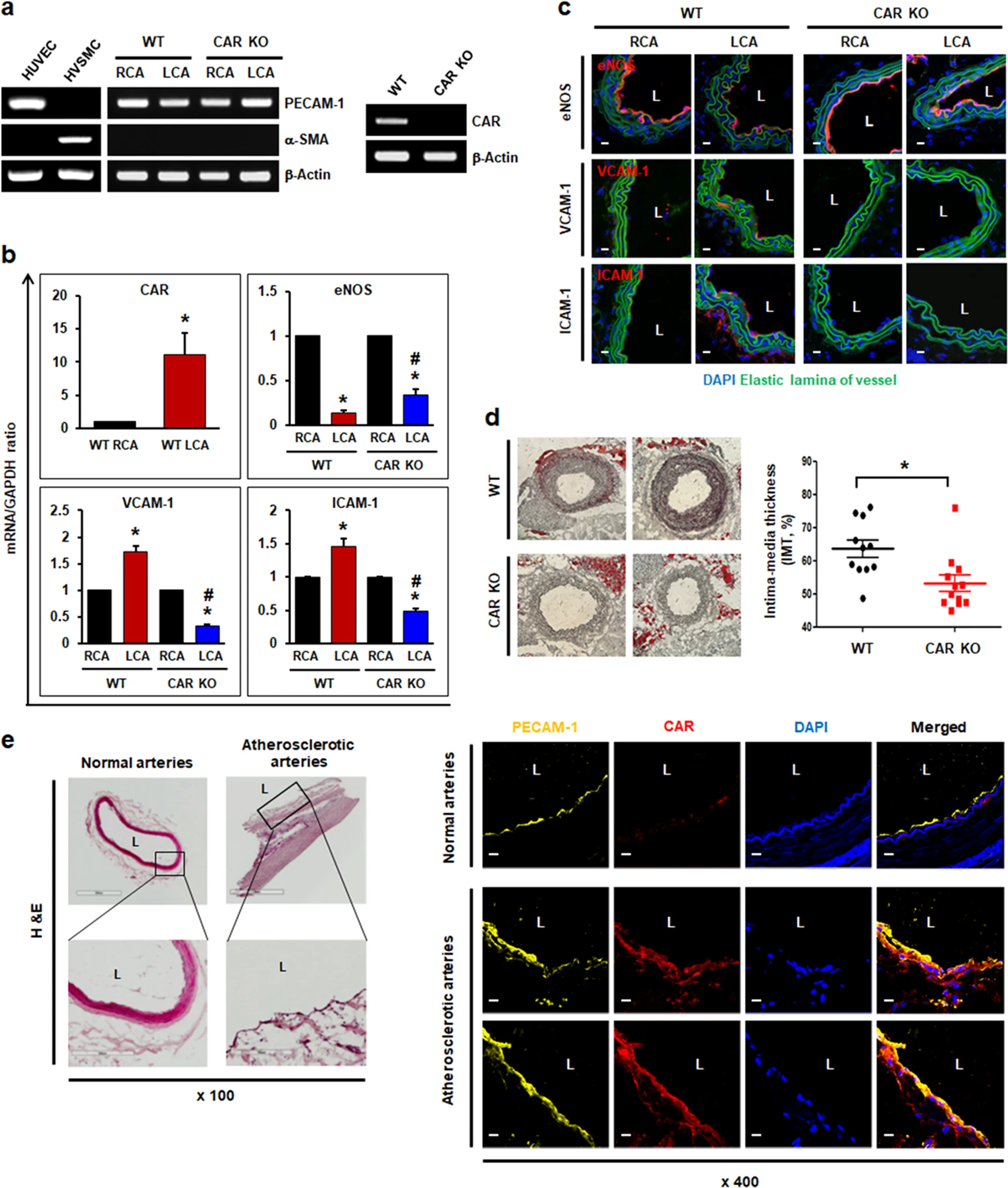
图4 CAR 缺失在扰动流下保护致动脉粥样硬化内皮细胞。
(a) LCA 结扎 24 小时后,对小鼠实施安乐死,并从两侧颈动脉中提取富含 EC 的 RNA。
(b)通过实时 PCR 测定富含 EC 的 RNA 中编码 eNOS、VCAM-1 和 ICAM-1 的 mRNA 水平。
(c)在来自 WT 或 EC 特异性 CAR KO 小鼠的颈动脉中进行免疫荧光染色。
(d)通过油红 O 染色在结扎的 LCA 中观察到扰动流诱导的动脉粥样硬化斑块形成。
(e)人动脉组织用苏木精和伊红(H&E)以及抗 PECAM-1 和抗 CAR 抗体染色。PECAM-1 用作内皮特异性标志物。
CAR通过调节PECAM-1磷酸化调节FSS诱导的内皮机械转导
为了探索 CAR 在 ECs 对剪切应力响应中的机械转导信号传导功能,评估了 Src、PI3K、Akt 和 eNOS 在转染 siCAR 或质粒编码 CAR 的 HUVECs 中的磷酸化。LSS 诱导 Src(pY416,活性形式)、PI3K、Akt 和 eNOS 的激活,而 OSS 不激活这些分子。在 Src 磷酸化方面,与 LSS 相比,OSS 中 Src 的 Y527 抑制形式增加。CAR 敲低逆转了 OSS 中 Src(Y416)、PI3K、Akt 和 eNOS 的磷酸化降低,而 Src(Y527)的磷酸化受到抑制(图5 a)。相反,CAR过表达消除了Src(Y416)、PI3K、Akt和eNOS的激活以及LSS诱导的Src磷酸化(Y527)的降低(图5 b)。
为了确定 CAR 对 PECAM-1 磷酸化的影响,评估了 PECAM-1 免疫沉淀物中的酪氨酸磷酸化。通过CAR敲低恢复了OSS下PECAM-1的磷酸化降低,而CAR过表达消除了LSS下增强的PECAM-1磷酸化(图5 c)。使用共聚焦显微镜,发现 CAR 与 PECAM-1 共定位(图5 d)。因此,通过基于免疫染色的原位邻近连接测定(PLA)研究了 CAR 与暴露于扰动流的 HUVECs 中机械感觉复合物之间的内源性蛋白质-蛋白质相互作用。PLA揭示了在OSS下表达增加的CAR与HUVECs中的机械感觉复合物物理相关性(图5 e)。
总之,这些发现表明CAR与ECs中的PECAM-1和其他机械感觉复合物蛋白具有密切的物理关系,并且在FSS条件下,通过CAR与机械感觉复合物或其他蛋白质之间的相互作用,PECAM-1的磷酸化受CAR调控。
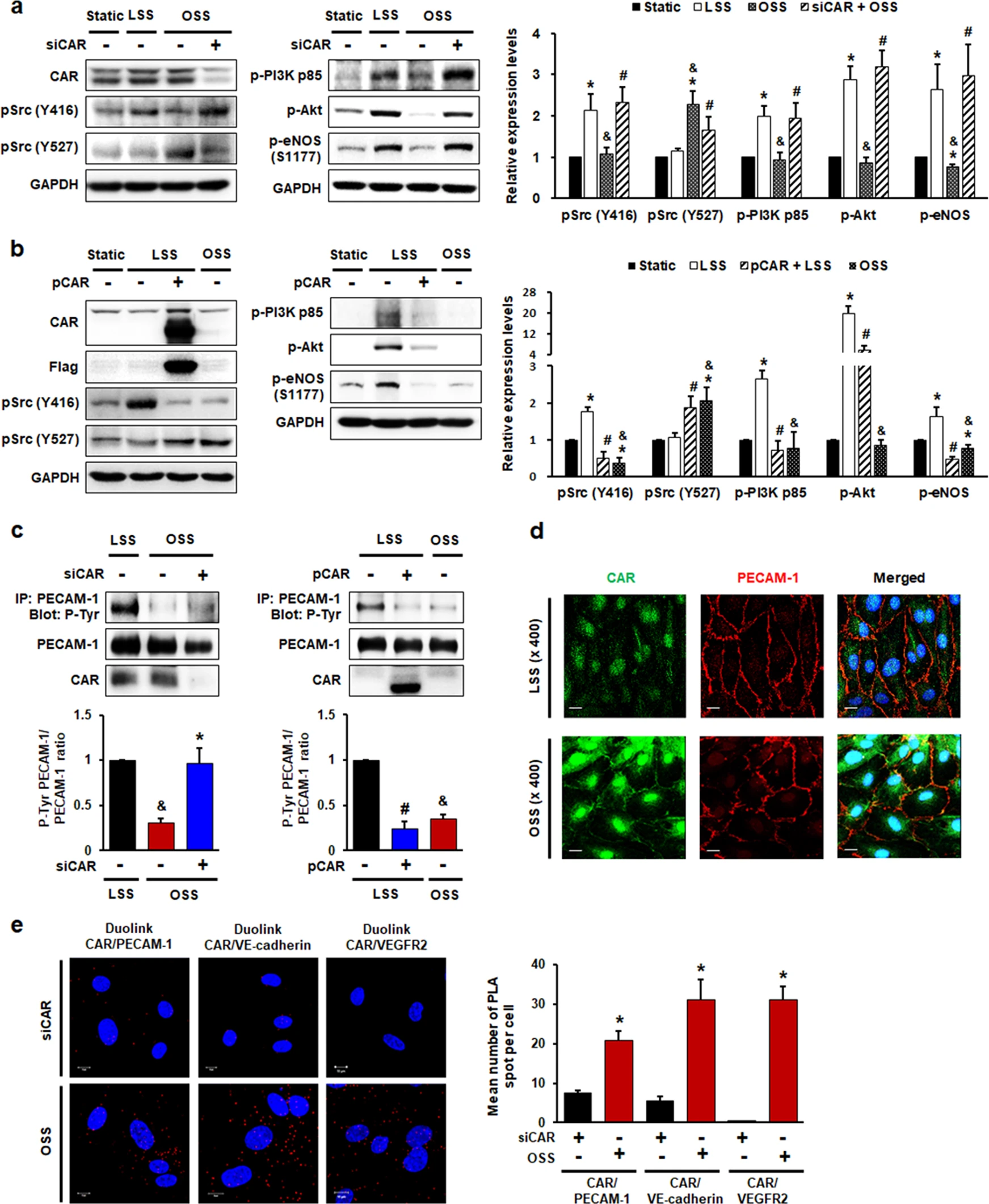
图5 CAR 在受干扰的流动下充当内皮细胞中的机械转导调节剂。
用针对 CAR的 siRNA(a、c、e)或编码 CAR 的标记质粒(b、c)转染的 HUVECs 暴露于 FSS。评估 Src 在 Y416(活性形式)和 Y527(抑制形式)、PI3K、Akt 和 eNOS(S1177)处的磷酸化。
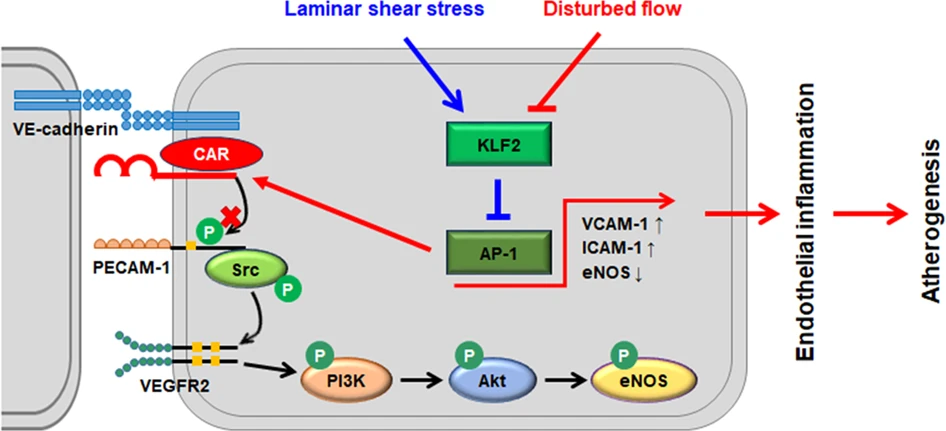
图6 FSS 下 CAR 在内皮机械转导信号中的示意图。
内皮 CAR 表达受 FSS 调节。扰动流增加,层流剪切应力降低,ECs 中的 CAR 表达,CAR 表达的这些变化是通过 KLF2-AP-1 轴调节的。扰流诱导的 CAR 抑制 PECAM-1 的磷酸化,导致通过磷酸化 Src、PI3K、Akt 和 eNOS 抑制内皮机械转导信号。因此,CAR 通过阻断 PECAM-1 磷酸化来调节 ECs 中的机械转导,从而影响内皮功能和血管病理生理学。
总之,这项研究提供了新的证据,表明 FSS 调节 ECs 中的 CAR 表达,并且扰动流通过 KLF2/AP-1 途径上调 CAR。抑制 CAR 表达通过抑制 NF-κB 活化来下调促炎基因的表达,从而减少体外和体内流动紊乱下的内皮炎症,然后延迟动脉粥样硬化形成。CAR 抑制 PECAM-1 的磷酸化,从而抑制内皮机械转导信号。这些结果表明,CAR 是 ECs 中机械转导的重要调节剂,通过阻断 PECAM-1 磷酸化发挥作用,从而影响内皮功能和血管病理生理学。因此,CAR参与了血管功能的维护,并有望成为治疗血流紊乱性血管疾病(如动脉粥样硬化)的靶点。
参考文献:Chung J, Kim KH, An SH, Lee S, Lim BK, Kang SW, Kwon K. Coxsackievirus and adenovirus receptor mediates the responses of endothelial cells to fluid shear stress. Exp Mol Med. 2019 Nov 27;51(11):1-15. doi: 10.1038/s12276-019-0347-7. PMID: 31776326; PMCID: PMC6881322.
原文链接:https://pubmed-ncbi-nlm-nih-gov.proxy.library.carleton.ca/31776326/
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。
微信搜索公众号“Naturethink”,学习更多关于流体机械力学刺激细胞培养相关知识吧!

新鲁汶大学的公报指出,如今抗生素耐药菌的出现给人类和医药带来了新 ...

根据“生物安全关键技术研发”重点专项评审工作安排,生物中心将于2 ...

2018年度国家科学技术奖提名工作已结束,国家科学技术奖励工作办 ...

为更好的向用户、潜在用户提供我们的产品,即日起推出如下活动:凡向 ...

据英国《自然·通讯》杂志日前发表的一篇医学论文报告,科学家发现了 ...

“免疫系统在高血压中扮演了未曾预料的重要角色。”英国格拉斯哥大学 ...

“来一场中国制造的品质革命!”3月5日,李总理在政府工作报告中发 ...

美国侨报网近日刊文称,一项新出炉的研究警告称,即使是失眠一夜,也 ...

我司自主研发产品,重视知识产权,已拥有多项专利证书! ...

Naturethink网站及微信内容逐步完善,敬请查阅! ...
公司完成细胞张应变与压力综合培养仪器的研发; ...

2018年春节将至,我司放假时间安排为:2月14日至2月21日, ...

为提高区域自主创新能力,推进区域科技创新体系建设,加大创新驱动区 ...

澳大利亚和英国一项研究显示,对于几乎任何年龄段的人群而言,快走都 ...

2018年国家自然科学基金项目申请工作已开始,你准备好了吗? ...
癌症在促进肿瘤表型表观遗传重编程和修饰的复杂组织微环境中发展。此 ...
壁面剪切应力(WSS),是单位面积上由血管表面流动的液体产生的接 ...
炎症是机体受到外界微生物入侵后的一种保护性反应。作为影响最大的炎 ...