

新鲁汶大学的公报指出,如今抗生素耐药菌的出现给人类和医药带来了新 ...

根据“生物安全关键技术研发”重点专项评审工作安排,生物中心将于2 ...

2018年度国家科学技术奖提名工作已结束,国家科学技术奖励工作办 ...

为更好的向用户、潜在用户提供我们的产品,即日起推出如下活动:凡向 ...

据英国《自然·通讯》杂志日前发表的一篇医学论文报告,科学家发现了 ...

“免疫系统在高血压中扮演了未曾预料的重要角色。”英国格拉斯哥大学 ...

“来一场中国制造的品质革命!”3月5日,李总理在政府工作报告中发 ...

美国侨报网近日刊文称,一项新出炉的研究警告称,即使是失眠一夜,也 ...

我司自主研发产品,重视知识产权,已拥有多项专利证书! ...

Naturethink网站及微信内容逐步完善,敬请查阅! ...
公司完成细胞张应变与压力综合培养仪器的研发; ...

2018年春节将至,我司放假时间安排为:2月14日至2月21日, ...

为提高区域自主创新能力,推进区域科技创新体系建设,加大创新驱动区 ...

澳大利亚和英国一项研究显示,对于几乎任何年龄段的人群而言,快走都 ...

2018年国家自然科学基金项目申请工作已开始,你准备好了吗? ...
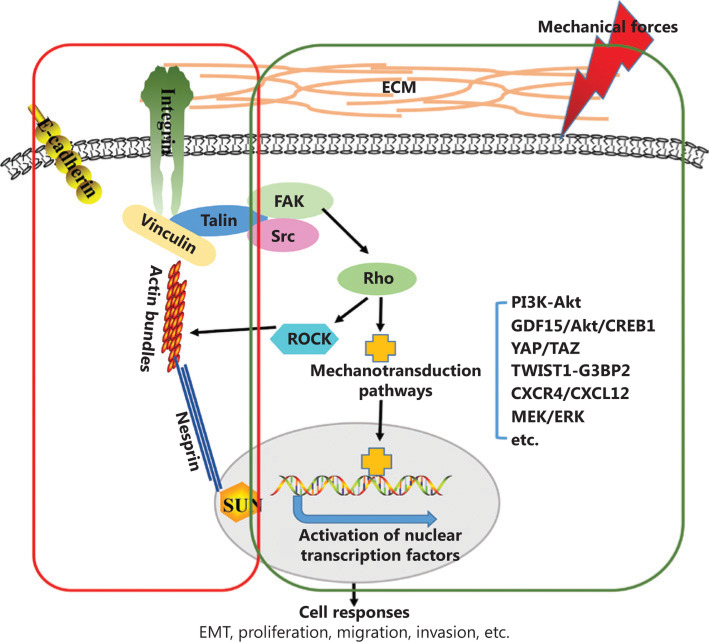
癌症在促进肿瘤表型表观遗传重编程和修饰的复杂组织微环境中发展。此 ...
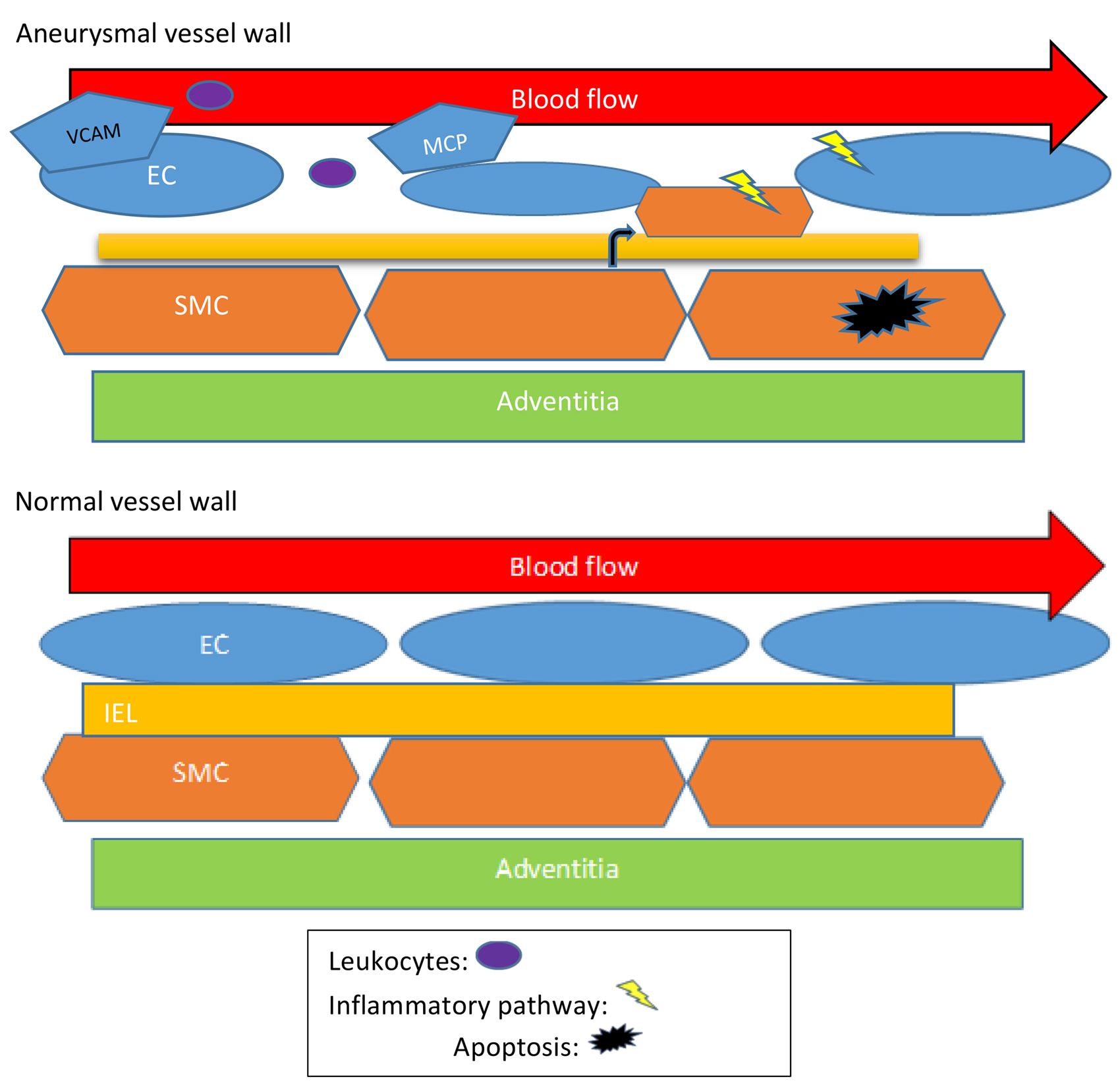
壁面剪切应力(WSS),是单位面积上由血管表面流动的液体产生的接 ...
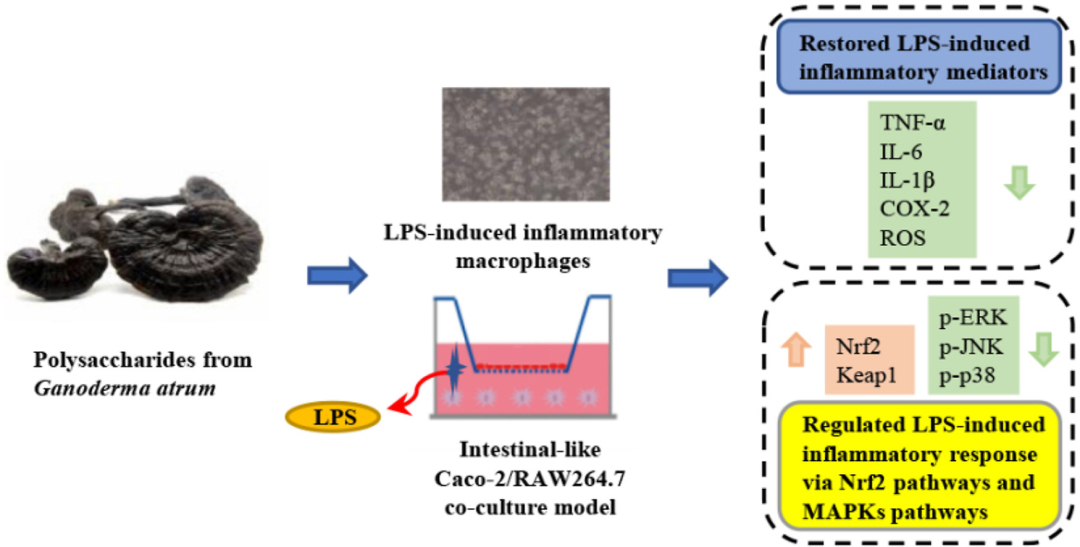
炎症是机体受到外界微生物入侵后的一种保护性反应。作为影响最大的炎 ...