由机械力刺激引起的正畸牙齿移动(OTM)是一种独特的骨重塑过程,需要牙周韧带(PDL)的参与。在牙齿移动过程中,在受压侧,PDL 被压缩,牙槽骨被吸收,而骨沉积在与受力方向相反的张力侧被激活。众所周知,张力区的骨形成有助于牙齿运动的长期稳定性。
牙周韧带细胞(PDLCs)是 PDL 的主要组成细胞,可以分化成成骨细胞来合成骨组织。同时,PDLCs 还通过合成和释放细胞因子、生长因子、神经递质和集落刺激因子为骨沉积提供有利的微环境。此外,这些因素可能调节间充质干细胞的迁移、增殖和分化,已发现间充质干细胞迁移到机械负荷的牙周组织并参与移动牙齿周围的骨重塑。尽管有这些发现,OTM 期间张力应变诱导骨形成的机制仍不清楚。在湖北省口腔基础医学省部共建国家重点实验室之前的研究中,发现成纤维细胞生长因子2(FGF2)和基质细胞衍生因子1(SDF-1)等特定生长因子和趋化因子显著上调。cAMP 反应元件结合蛋白(CREB)被进一步鉴定为该张力应变激活反应中的核心蛋白之一。
CREB 是一种亮氨酸拉链转录因子,可通过与保守的启动子序列(TGACGTCA)结合来调节许多 cAMP 反应基因。CREB 通过调节多种神经营养因子、细胞生长因子和细胞因子参与各种生物过程,包括细胞分化、增殖和迁移。
在本研究中,该团队发现 CREB 的表达和磷酸化在正畸张力应变刺激下升高。此外,FGF2 和 SDF-1 的表达也上调。假设 CREB 可能通过转录激活 SDF-1 和 FGF2 并增强 BMSCs 的迁移和分化。体外分析结果表明,PDLCs 中 CREB 的过表达上调 FGF2 和 SDF-1 的表达,而 CREB 的抑制减弱了 FGF2 和 SDF-1 的升高。研究进一步探索了 CREB 如何反式激活 FGF2 和 SDF-1 启动子,并在其启动子中鉴定了 cAMP 调节的增强子元件(CRE)。

应用正畸张力应变的 PDLCs 增强 BMSCs 迁移和成骨分化
为了研究 BMSCs 在张力部位的功能,实验生成了一个 OTM 小鼠模型。高倍放大图像显示张力部位的板层骨形成和骨腔周围的圆形骨形成(图1 A)。
为了更详细地确定新骨的起源,比较了 PDL 中 Periostin(骨膜蛋白)、OCN 和 αSMA 的表达。OCN 被认为是成熟成骨细胞和骨形成率的标志物。骨膜蛋白已被视为牙周韧带细胞的标志物。有研究提出,表达 αSMA 的祖细胞/干细胞位于 PDL 的血管周围区域,可以分化为成骨细胞、成牙骨质细胞和成纤维细胞。在移动牙齿的张力部位的 PDL 中,αSMA 的表达与骨膜蛋白的表达不重叠。αSMA 阳性(αSMA+)细胞和骨膜蛋白阳性(Periostin+)细胞均可检测到 OCN(图1 E)。这些结果表明,PDL 中 PDLCs 衍生的成骨细胞和 BMSCs 衍生的成骨细胞均参与骨形成。
为了更好地了解正畸牙齿移动过程中 PDLCs 和 BMSCs 之间的关联,建立了一个张力应变系统,对牙周韧带细胞(PDLCs)施加循环张力应变(CTS,重复 5 秒拉伸和 5 秒松弛,持续48小时)。从应用 CTS 的 PDLCs 收集条件培养基并用于人类 BMSCs。与用对照培养基处理的相比,用 CTS 培养基处理的 BMSCs 显示 ALP 染色和茜素红染色增强(图1 B)。同时,与对照处理相比,用 CTS 培养基处理 BMSCs 的细胞迁移率大大提高(图1 C、D)。这些发现表明,PDLCs 可以响应机械张力应变并增强 BMSCs 的迁移和分化。

图1 应用张力应变的 PDLCs 增强了 BMSCs 的迁移和分化。
正畸张力应变诱导的骨形成中 CREB 表达增加
为了检查 CREB 是否参与正畸张力应变诱导的骨形成,首先评估了其在机械负荷磨牙牙周组织中的表达。免疫组化染色显示,OTM 小鼠在第 3、6、12 天的张力部位 P-CREB 表达显著增加。在对照的对侧部位观察到较弱的免疫反应(图 2 A 、B)。
为了更详细地确定 CREB 的起源,比较了第 3 天实验 OTM 样品中骨膜蛋白和 CREB 的表达。骨膜蛋白定位于 PDL。CREB 主要在 Periostin+ 细胞的细胞核中检测到,表明 CREB 表达在除 BMSCs 之外的 PDLCs 中增加(图2 C)。实时 RT-PCR 结果显示,体外 CTS 刺激的 PDLCs 中 CREB 的 mRNA 水平在 24、48 和 72 小时显著上调(图2 D)。免疫印迹结果还显示,CREB 和 P-CREB 的表达在 24 小时后显著增加(图2 E)。
实验分析了 CTS 应用的 PDLCs 中环磷腺苷(cyclic AMP)的产生。与未处理组相比,CTS 处理的 PDLCs 中环磷腺苷的表达从 12 小时到 48 小时持续增加并稳定在 72 小时(图2 F)。cAMP 对 CTS 的反应趋势与 CREB 相似但略早于 CREB。这些结果清楚地表明,在 OTM 期间,在正畸张力应变诱导的骨形成期间,PDL 中 cAMP 和 CREB 的表达增加。

图2 在正畸张力负荷下,CREB在牙周韧带中的表达增加。
正畸张力应变刺激 PDLCs 中 FGF2 和 SDF-1 的表达
通过实时 RT-PCR 分析检查了 CTS 处理的 PDLCs中 FGF2 和 SDF-1 的 mRNA 表达。结果显示,24 小时后 FGF2 和 SDF-1 的 mRNA 表达上调(图3 A、B)。此外,ELISA 结果显示,与对照培养基相比,CTS 处理的 PDLCs 条件培养基中 FGF2 和 SDF-1 的浓度显著增加(图3 C、D)。此外还发现,OTM 模型中牙周韧带张力部位的 FGF2 和 SDF-1 水平升高。免疫组化染色显示,FGF2 的表达在第 3 天和第 6 天显著增加,然后在第 12 天恢复正常(图3 E、F)。SDF-1 在第 3 天高表达,然后在第 6 天和第 12 天减少(图3 G、H)。
实验比较了第 3 天实验 OTM 样品中骨膜蛋白和 FGF2 或 SDF-1 的表达。FGF2 和 SDF-1 主要在 Periostin+ 细胞中检测到,表明 FGF2 和 SDF-1 是由除 BMSCs 以外的 PDLCs 分泌的(图 4)。这些发现表明,机械张力可以诱导 PDLCs 在张力部位表达和分泌 FGF2 和 SDF-1。

图3 正畸张力负荷刺激牙周韧带中 FGF2 和 SDF-1 的表达。

图4 FGF2 和 SDF-1 在 OTM 小鼠模型中由 PDLCs 分泌。
CREB 增强 PDLCs 介导的 BMSCs 成骨和迁移
为了确定 PDLCs 中 CREB 表达是否可以调节 BMSCs 的成骨和迁移,在 PDLCs 中生成了表达 CREB 或失去转录活性的显性阴性形式的 CREB(KCREB)的慢病毒。免疫印迹结果显示,CREB 和 KCREB 在慢病毒感染后在 PDLCs 中过表达。结果显示,用来自 CREB 过表达 PDLCs 的条件培养基处理的 BMSCs 的迁移率显著上调,而 KCREB 组的迁移率下调(图5 A、B)。
此外,还检查了它们对成骨细胞分化的影响。用来自 CREB 过表达的 PDLCs 的条件培养基处理,BMSCs 的 ALP 活性和矿化能力显著上调;而用来自 KCREB 表达的 PDLCs 的条件培养基处理时,其下调(图5 C、D)。这些数据表明,CREB 在 PDLCs 中的表达可能在调节信号分子分泌中发挥作用,从而增强 BMSCs 的迁移和成骨细胞分化。
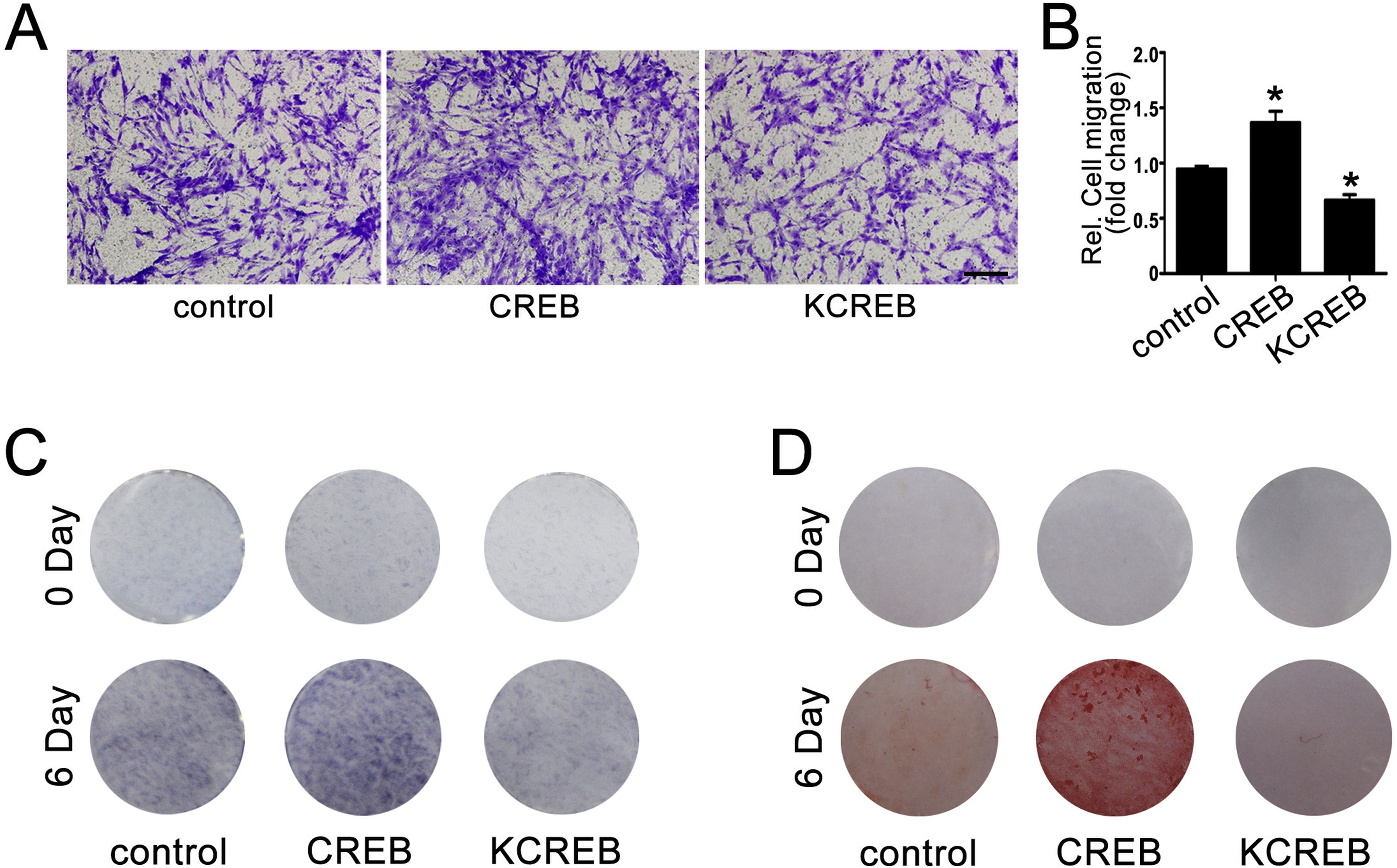
图5 CREB 增强 CTS-PDLCs 介导的 BMSCs 的成骨和迁移。
CREB 转录调节 FGF2 和 SDF-1 的表达
为了研究 CREB 是否可以调节 FGF2 和 SDF-1 的表达,对感染 PDLCs 的条件培养基进行了 ELISA 检测。结果显示,FGF2 和 SDF-1 的表达在 CREB 过表达的 PDLCs 条件培养基中显著上调,而在来自 KCREB 表达的 PDLCs 的条件培养基中下调(图6 A、B)。SiRNAs 也被转染到 PDLCs 中以抑制 CREB 的表达。实时 RT-PCR 结果显示,在 siCREB-b 和 siCREB-c 转染细胞中 CREB 表达显著下调(图6 C)。
使用 siCREB-c,检查了 CREB 的抑制是否可以减弱 CTS 处理的 PDLCs 中 FGF2 和 SDF-1 的升高。ELISA 结果显示,siCREB-c 降低了 CTS 处理的 PDLCs 条件培养基中 FGF2 和 SDF-1 的增加(图6 D、E)。这些发现表明,CREB 可能在 CTS 应用的 PDLCs 中充当 FGF2 和 SDF-1 的上游调控因子。
实验进一步探索了CREB 调控 FGF2 和 SDF-1 表达的机制,分析了 2 kb FGF2 和 SDF1 启动子片段中的潜在调控元件。结果显示,FGF2 启动子在 -1496bp∼-1489bp(m2)和 -47bp∼-40bp(m5)位点的突变大大降低了 CREB 转录激活(图6 F)。对于 SDF-1 启动子,-1203bp~-1196bp(m2)位点的突变大大减弱了转录激活(图6 G)。这些发现表明,CREB 通过与 FGF2 启动子的 -1496bp~-1489bp 和 -47bp~-40bp 位点的 CREs 相互作用来转录激活 FGF2 表达。它还通过与位于 SDF-1 启动子的 -1203bp∼-1196bp 的 CRE 相互作用来激活 SDF-1 表达。

图6 在张力应变处理下,CREB 转录激活 FGF2 和 SDF-1 的表达。
总之,这些结果表明,CREB 在张力刺激下增加了 SDF-1 和 FGF2 的表达,从而调节了 BMSCs 的迁移和成骨细胞分化。研究对 CREB 调节 SDF-1 和 FGF2 以促进骨形成的发现揭示了 OTM 期间张力部位骨形成的潜在机制。
参考文献:Chang M, Lin H, Fu H, Wang J, Yang Y, Wan Z, Han G. CREB activation affects mesenchymal stem cell migration and differentiation in periodontal tissues due to orthodontic force. Int J Biochem Cell Biol. 2020 Dec;129:105862. doi: 10.1016/j.biocel.2020.105862. Epub 2020 Oct 10. PMID: 33045372.
原文链接:https://pubmed-ncbi-nlm-nih-gov.proxy.library.carleton.ca/33045372/
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。
微信搜索公众号“Naturethink”,学习更多细胞牵张拉伸技术及应用!

新鲁汶大学的公报指出,如今抗生素耐药菌的出现给人类和医药带来了新 ...

根据“生物安全关键技术研发”重点专项评审工作安排,生物中心将于2 ...

为更好的向用户、潜在用户提供我们的产品,即日起推出如下活动:凡向 ...

2018年度国家科学技术奖提名工作已结束,国家科学技术奖励工作办 ...

据英国《自然·通讯》杂志日前发表的一篇医学论文报告,科学家发现了 ...

Naturethink祝愿伟大祖国繁荣昌盛,欣欣向荣! ...

“免疫系统在高血压中扮演了未曾预料的重要角色。”英国格拉斯哥大学 ...

“来一场中国制造的品质革命!”3月5日,李克强总理在政府工作报告 ...

我司自主研发产品,重视知识产权,已拥有多项专利证书! ...

美国侨报网近日刊文称,一项新出炉的研究警告称,即使是失眠一夜,也 ...
公司完成细胞张应变与压力综合培养仪器的研发; ...

Naturethink网站及微信内容逐步完善,敬请查阅! ...

为提高区域自主创新能力,推进区域科技创新体系建设,加大创新驱动区 ...

2018年春节将至,我司放假时间安排为:2月14日至2月21日, ...

澳大利亚和英国一项研究显示,对于几乎任何年龄段的人群而言,快走都 ...

2018年国家自然科学基金项目申请工作已开始,你准备好了吗? ...
壁面剪切应力(WSS),是单位面积上由血管表面流动的液体产生的接 ...
癌症在促进肿瘤表型表观遗传重编程和修饰的复杂组织微环境中发展。此 ...