人类牙周韧带来源的干细胞(PDLSCs)是牙周韧带(PDL)中的主要功能性骨祖细胞,通过机械传感和信号传导参与适应性活动。目前对调节PDLSCs中成骨活性的机械力诱导的细胞内信号级联的研究已经获得了进展。然而,关于将外在机械应力与内在生化反应联系起来的机械传感器的知识是有限的。
尽管在机械力诱导的PDLSCs中,已经发现了一些用于控制成骨的膜嵌入蛋白,但许多位于或横跨细胞膜上的感觉元件仍有待定义。LRP6是一种Wnt跨膜受体,通过激活Wnt/β-连环蛋白信号通路在细胞机械传感中发挥一系列重要作用。最近,LRP6被发现是参与牙齿发育、少牙畸形和口腔鳞状细胞癌等牙齿生理和病理活动的关键调节因子。因此,推测PDLSCs中的LRP6是一种候选响应传感器,可响应机械应力并介导成骨作用。
基于此,山东大学口腔医学院口腔正畸科、山东省口腔组织再生重点实验室等联合团队的一项研究旨在阐明在正畸牙齿移动(OTM)期间机械诱导的PDLSCs中调节成骨活动的关键传感器机械信号。

LRP6在机械力诱导的PDLSCs和PDL组织中的表达增强
在体外,将培养的细胞暴露于循环拉伸应力(CSS,10% 伸长率,0.5 Hz)中6,12和24小时,模拟体内机械力负荷。与无拉伸组相比,LRP6的表达呈时间依赖性上调,拉伸24 h上调最为明显。磷酸化的LRP6(P-LRP6)表现出相同的趋势。CSS加载上调了P-LRP6/总LRP6的蛋白质水平比值,且在24 h观察到最显著的变化。免疫荧光证实,拉伸24 h 后LRP6显著升高。因此,后续的研究中采用了拉伸24小时。
这些数据表明,LRP6可能与PDLSCs对机械力的响应有关。此外,HE染色显示PDL组织张力侧的体内分散。实验观察到LRP6表达分布在整个牙周组织中,其表达从第0-7天逐渐上调。第14天LRP6表达量较第3天和第7天下降。这些数据进一步暗示LRP6可能参与OTM期间的牙槽骨重塑。
LRP6失活抑制了机械力诱导的PDLSCs中的成骨作用
LRP6在机械力诱导的PDLSCs中的表达升高,伴随着增殖和成骨能力的提高,表现为增殖标志物(PCNA)和成骨标志物(ALP和RUNX2)的表达显著增加(图1 a、b)。接下来,实验通过构建慢病毒载体抑制LRP6表达,以阐明LRP6在PDLSCs中机械力依赖性成骨性能中的作用。拉伸6 h后,sh-LRP6组P-LRP6和LRP6的蛋白水平显著下调(图1 c)。LRP6的mRNA表达也发生相同变化(图1 d),且sh-LRP6组中P-LRP6/总LRP6的比例升高,表明与总蛋白相比磷酸化下降趋势较慢(图1 e)。此外,LRP6敲低减弱了增殖标志物(PCNA)和成骨标志物(ALP,RUNX2,OSX)的表达(图1 f、g)。同时,在sh-LRP6组中Ki-67阳性细胞的比例显著下降(图1 h、i),ALP染色显著减弱(图1 j),ALP活性显著降低(图1 k),验证了LRP6缺失细胞的增殖和成骨能力降低。这些数据表明,LRP6参与调节PDLSCs的机械力依赖性增殖和成骨分化。

图1 LRP6失活抑制了机械力诱导的PDLSC中的成骨作用。
LRP6失活破坏了机械力诱导的PDLSCs中的F-肌动蛋白动力学
令人惊讶的是,在sh-LRP6组中观察到细胞面积和形态的异常变化,其中LRP6缺失细胞在拉伸24 h后接触面积明显增大,细胞圆度变小,宽长比降低。肌动蛋白细胞骨架重排对于维持机械力诱导的细胞形状是必要的。因此,实验假设LRP6是机械力诱导PDLSCs中F-肌动蛋白动力学的关键调节因子。实际上,在CSS下的sh-LRP6组中β-肌动蛋白单体合成和F-肌动蛋白聚合受到严重抑制。在机械力诱导的PDLSCs中,F-肌动蛋白动力学所需的F-肌动蛋白上游调节因子(RHOA和ROCK1)的表达也显著降低。此外,在 CSS 下的 sh-LRP6 组中 F-肌动蛋白定向紊乱且明显拉长,连续性也显然被破坏。LRP6缺失细胞中F-肌动蛋白密度也显著降低。这些数据表明,激活LRP6促进了机械力诱导的PDLSCs中的F-肌动蛋白动力学,并可能在OTM期间促进PDL组织的结构稳态。
破坏F-肌动蛋白动力学抑制了机械力诱导的PDLSCs中的成骨作用
然后实验研究了LRP6介导的F-肌动蛋白动力学是否参与机械力依赖性成骨作用。首先在力诱导的PDLSCs和PDL组织中检测到β-肌动蛋白表达。与LRP6表达模式一致的β-肌动蛋白的表达从第0-7天显示出显著的积累,并在体内第14天略有下降(图2 a、b),但在体外拉伸后稳定升高(图2 c-e)。这些数据进一步证实,PDLSCs中的LRP6的缺失破坏了机械力诱导的F-肌动蛋白组装。
接下来,使用有效的肌动蛋白聚合抑制剂Cyto D研究了F-肌动蛋白动力学对PDLSCs中机械力依赖性成骨性能的作用。如图2 f、g 所示,Cyto D抑制ALP、RUNX2、OSX和PCNA的表达,同时抑制β-肌动蛋白的表达。然后,Cyto D引起的Ki-67阳性细胞比例的显著降低(图2 h)和ALP染色的弱化(图2 i),验证了由于F-肌动蛋白动力学破坏而导致PDLSCs中力依赖性成骨作用的减弱能力。因此,实验确定F-肌动蛋白是LRP6信号传导的关键下游分支,调节PDLSCs中机械力依赖性的成骨作用。

图2 破坏的F-肌动蛋白动力学抑制了力诱导的PDLSC中的成骨作用。
LRP6/F-肌动蛋白轴调节机械力诱导的PDLSCs中YAP核易位和激活
YAP通过穿梭进入细胞核起作用,是PDLSCs中机械力依赖性成骨作用的关键转录介质。研究人员推测YAP作为与LRP6 / F-肌动蛋白轴信号协调的关键传感器,最终有助于PDLSCs中的力依赖性成骨作用。因此,首先研究了LRP6表达与YAP定位、磷酸化和转录活性之间的关系。LRP6敲低将核YAP重新定位到细胞质,尽管YAP在CSS加载后主要集中在细胞核中(图3 a、b)。同时,观察到LRP6敲低诱导YAP磷酸化(图3 c、d)。值得注意的是,YAP靶基因在LRP6缺失细胞中的表达显著降低(图3 e)。此外,Cyto D还将核YAP重新定位到机械力诱导的PDLSCs中的细胞质上(图3 f、g),且诱导YAP磷酸化(图3 h、i),降低YAP靶基因表达(图3 j)。这些数据表明,PDLSCs中的LRP6敲低干扰了F-肌动蛋白动力学,进一步调控YAP核易位和随后的转录反应(图4)。

图3 LRP6 / F-肌动蛋白轴调节机械力诱导PDLSC中的YAP核易位和活化。

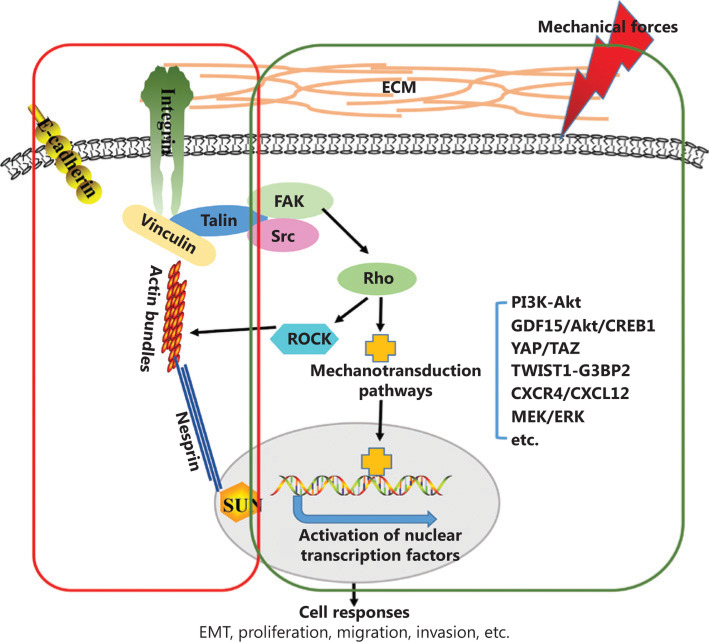
图4 所提出机制的示意图。
在由正畸应用引起的牙槽骨重塑过程中,机械力增强了PDLSCs中的LRP6膜定位。随后LRP6动员促进F-肌动蛋白聚合和重排,并进一步促进YAP穿梭到细胞核。活化的YAP随后促进细胞增殖和成骨分化,最终导致新的骨形成。
总之,这项研究揭示了一种独特的机械转导机制,用于控制成骨性能,以LRP6为中心,将机械线索连接到机械力诱导的PDLSCs中的F-肌动蛋白/ YAP级联。这些结果揭示了OTM的分子基础。
参考文献:Wang J, Yang H, Ma X, Liu J, Li L, Chen L, Wei F. LRP6/filamentous-actin signaling facilitates osteogenic commitment in mechanically induced periodontal ligament stem cells. Cell Mol Biol Lett. 2023 Jan 24;28(1):7. doi: 10.1186/s11658-023-00420-5. PMID: 36694134; PMCID: PMC9872397.
原文链接:https://pubmed.ncbi.nlm.nih.gov/36694134/
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。
微信搜索公众号“Naturethink”,了解更多细胞体外仿生培养技术及应用。

新鲁汶大学的公报指出,如今抗生素耐药菌的出现给人类和医药带来了新 ...

根据“生物安全关键技术研发”重点专项评审工作安排,生物中心将于2 ...

为更好的向用户、潜在用户提供我们的产品,即日起推出如下活动:凡向 ...

2018年度国家科学技术奖提名工作已结束,国家科学技术奖励工作办 ...

据英国《自然·通讯》杂志日前发表的一篇医学论文报告,科学家发现了 ...

Naturethink祝愿伟大祖国繁荣昌盛,欣欣向荣! ...

“免疫系统在高血压中扮演了未曾预料的重要角色。”英国格拉斯哥大学 ...

“来一场中国制造的品质革命!”3月5日,李克强总理在政府工作报告 ...

我司自主研发产品,重视知识产权,已拥有多项专利证书! ...

美国侨报网近日刊文称,一项新出炉的研究警告称,即使是失眠一夜,也 ...
公司完成细胞张应变与压力综合培养仪器的研发; ...

Naturethink网站及微信内容逐步完善,敬请查阅! ...

为提高区域自主创新能力,推进区域科技创新体系建设,加大创新驱动区 ...

2018年春节将至,我司放假时间安排为:2月14日至2月21日, ...

澳大利亚和英国一项研究显示,对于几乎任何年龄段的人群而言,快走都 ...

2018年国家自然科学基金项目申请工作已开始,你准备好了吗? ...
壁面剪切应力(WSS),是单位面积上由血管表面流动的液体产生的接 ...
癌症在促进肿瘤表型表观遗传重编程和修饰的复杂组织微环境中发展。此 ...