血管内表面的内皮细胞(ECs)从流动的血液中感知流体剪切应力(FSS),以调节数千种基因的表达并深刻影响EC表型。动脉粥样硬化的一个主要模式是可溶性炎症介质和剪切应激之间的协同作用,如高FSS阻断炎症转录通路的激活,如NF-kB(核因子κB)和c-Jun N-末端激酶,而低剪切应力允许或增强这些反应。转录因子KLF2由高FSS强烈诱导,并被认为介导其抗动脉粥样硬化作用的很大一部分。
研究发现,由TGFβ(转化生长因子β)分泌升高和ECs对TGFβ的敏感性增加驱动的内皮到间充质转化(EndMT)是动脉粥样硬化的主要原因。重要的是,TNFα(肿瘤坏死因子α)、白细胞介素1β(IL1β)和γ干扰素等细胞因子使ECs对TGFβ敏感,从而促进EndMT。事实上,TGFβ受体的内皮特异性敲除可显著减小斑块大小,甚至诱导斑块消退,这支持TGFβ信号通路在动脉粥样硬化的发生和进展中的作用。
在美国耶鲁大学医学院内科心血管研究中心、细胞生物学系、生物医学工程系团队的以往研究中表明,细胞信号转导分子Smad2/3的激活和核易位在低FSS下显示出明显的最大值,这归因于一个敏感的激活机制,该机制由 ≈1 dyne/cm2 的剪切力触发,并被 >15 dyne/cm2的高FSS抑制。然而,这些影响在炎症和动脉粥样硬化背景下的更广泛意义尚未得到探索。因此,该团队进一步探索了高FSS在调控TGFβ-Smad2/3-EndMT通路以响应可溶性致动脉粥样硬化生成因子中的作用,相关成果发表在Journal of the American Heart Association 题为High Fluid Shear Stress Inhibits Cytokine-Driven Smad2/3 Activation in Vascular Endothelial Cells。

首先,将基础培养基中的HUVECs在4 dynes/cm2 或25 dynes/cm2 的FSS或0.5±4 dynes/cm2 的振荡剪切应力(OSS)下添加TGFβ2或不添加的处理条件下持续6小时。结果发现,TGFβ2单独诱导了强烈的Smad2/3核易位,并在低FSS或OSS下进一步增加,但几乎完全被高FSS阻断(图1 A、B)。此外还测量了与间充质表型相关的Smad2/3靶基因,特别是FN1(纤连蛋白1)、N-钙粘蛋白、ID1(DNA结合抑制剂)、Snail2(蜗牛家族转录抑制因子2)和MMP2(基质金属蛋白酶2);还研究了细胞间粘附分子1(ICAM-1),它在动脉粥样硬化中介导白细胞募集到动脉壁,并由Smad2/3和NF-kB诱导。结果表明,低FSS对TGFβ的反应略有增加,而高FSS基本上消除了TGFβ诱导的Smad2/3靶基因的表达(图1 C)。因此,高FSS抑制TGFβ信号通路。
炎症介质在激活动脉粥样硬化中的EC Smad2/3信号转导中起重要作用,主要是使细胞对TGFβ敏感。因此,实验将HUVECs用炎性细胞因子IL1β处理,施加或不施加4 dynes/cm2 或25 dynes/cm2 的FSS或 0.5±4 dynes/cm2 的OSS并持续12小时。结果发现,IL1β单独诱导Smad2/3核易位,在LSS或OSS下进一步增加,但基本上完全被高FSS抑制。使用TNFα处理观察到几乎相同的结果。Smad2/3靶基因的测定证实了这些发现。因此,炎症诱导的Smad2/3信号传导也受到高FSS的抑制。
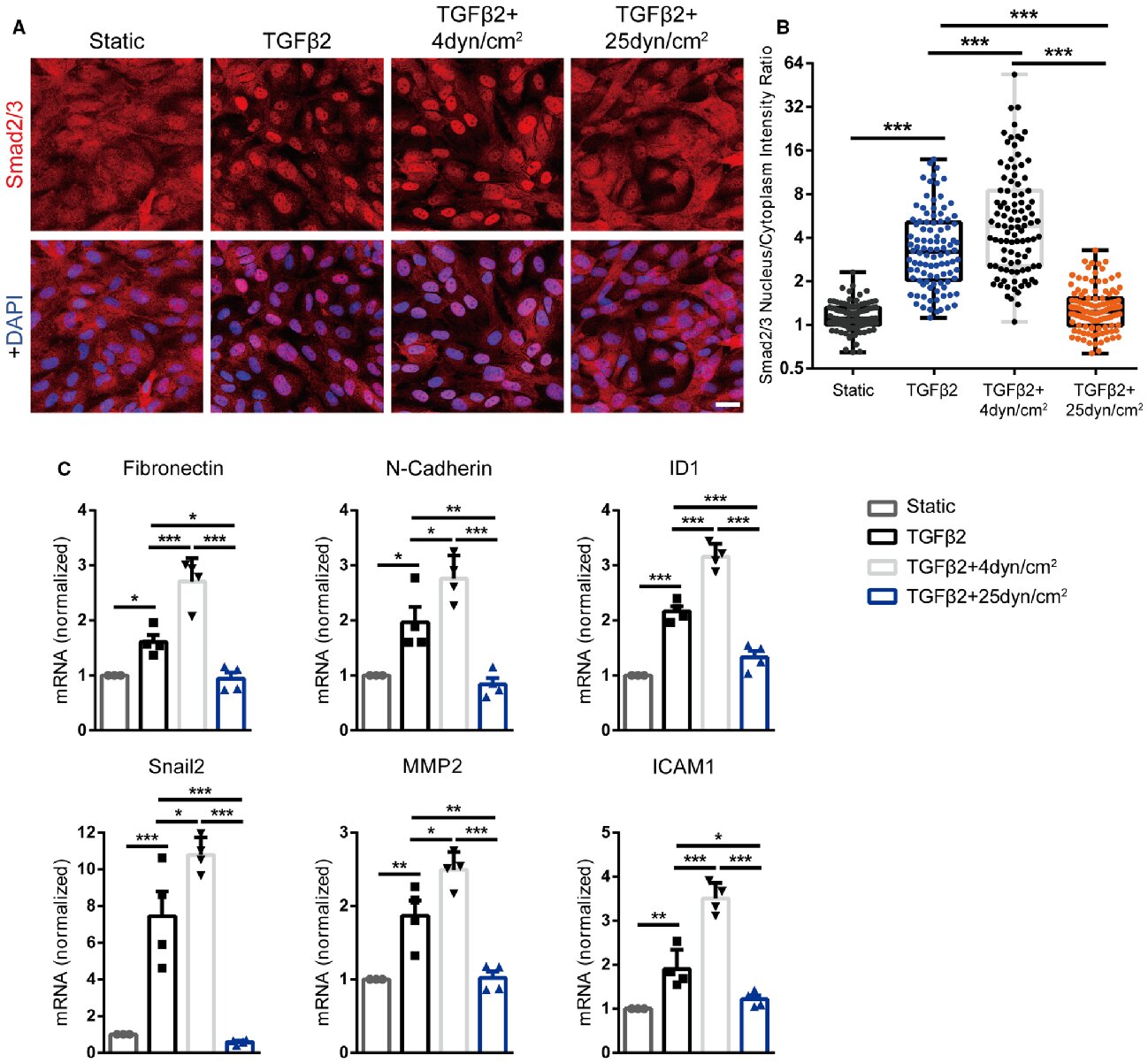
图1 FSS在体外阻止TGFβ2诱导的Smad2/3信号通路。
接下来,为了在体内验证这些结果,实验检测了注射TGFβ的小鼠的高FSS /动脉粥样硬化保护区域和低FSS /动脉粥样硬化易感区域的内皮反应,分别使用主动脉的外弯曲和内弯曲作为高和低/振荡FSS区域。结果发现,TGFβ强烈诱导内弯曲Smad2/3核易位,但在外弯曲作用微弱(图2 A、B)。对Smad2/3诱导基因,纤连蛋白和ICAM-1的检测表明,TGFβ同样诱导它们在内弯曲而不是外弯曲中的表达(图2 C-F)。因此,体内效果与体外效果呈相关性。
此外,实验同样试图验证IL1β和TNFα在体内的影响。向小鼠注射炎性细胞因子(IL1β和TNFα),随后在主动脉的不同区域检查Smad2/3核易位。结果发现,IL1β和TNFα均诱导Smad2/3在内弯曲中易位,但在外弯曲中没有;IL1β和TNFα诱导的Smad2/3诱导蛋白,纤连蛋白和ICAM-1同样在内弯曲而不是外弯曲中表达。因此,体内Smad2/3信号传导的激活与低FSS区域相关,并且在高FSS区域中基本上无法检测到。
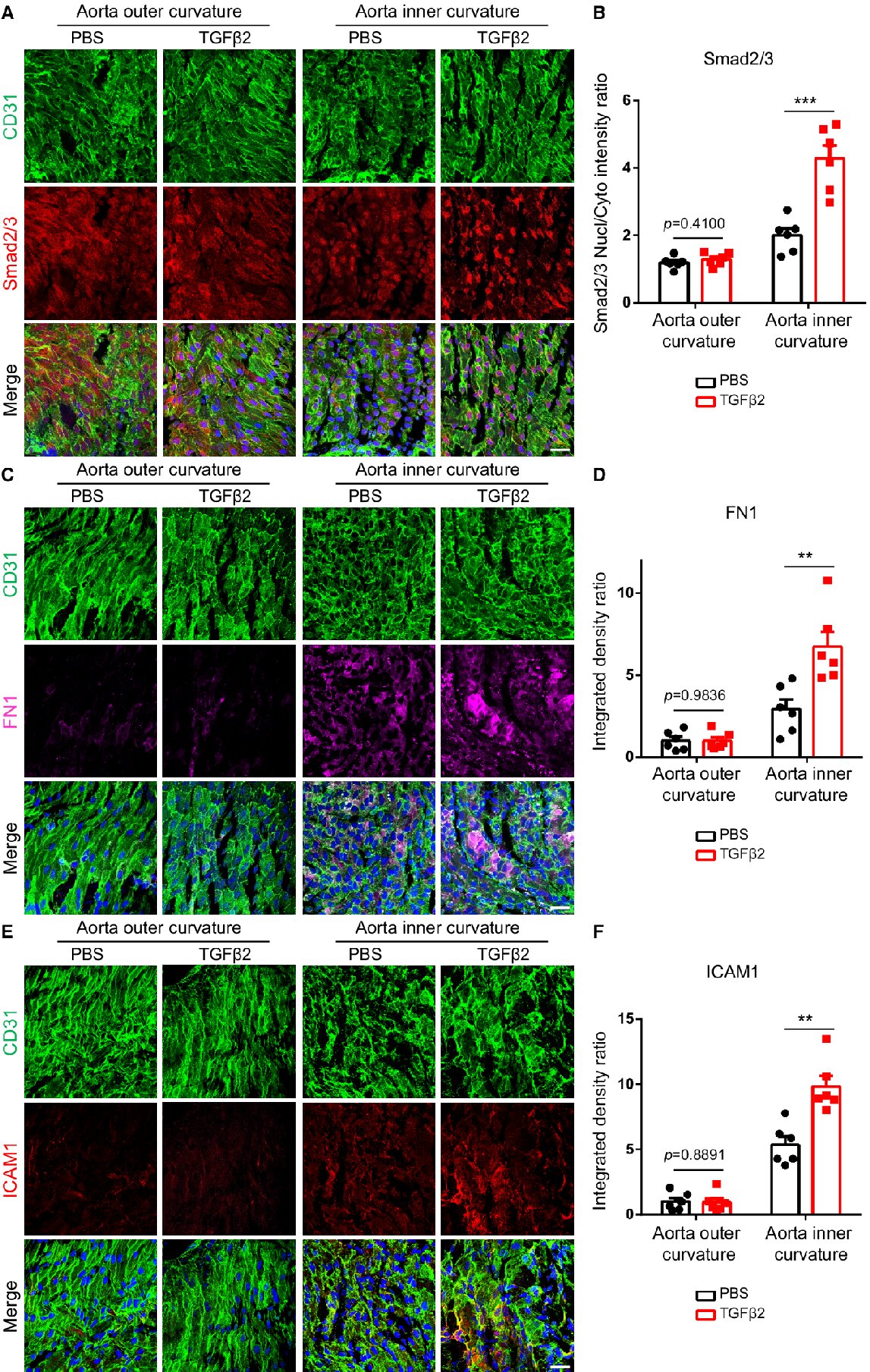
图2 FSS抑制体内TGFβ信号传导。
最后,为了确认细胞因子诱导的基因表达通过Smad2/3发生,实验利用siRNA介导的敲低在HUVECs中沉默Smad2/3,然后用TGFβ2或IL1β在4 dynes/cm2 或25 dynes/cm2 的FSS下处理ECs,并采用定量PCR分析基因表达。结果表明,Smad2/3敲低在所有条件下阻断了TGFβ2-和IL1β-诱导的FN1和N-钙粘蛋白的增加(图3 A、B)。因此,这些基因在ECs中的表达是Smad2/3依赖性的,Smad2/3在体外介导细胞因子诱导的基因表达。
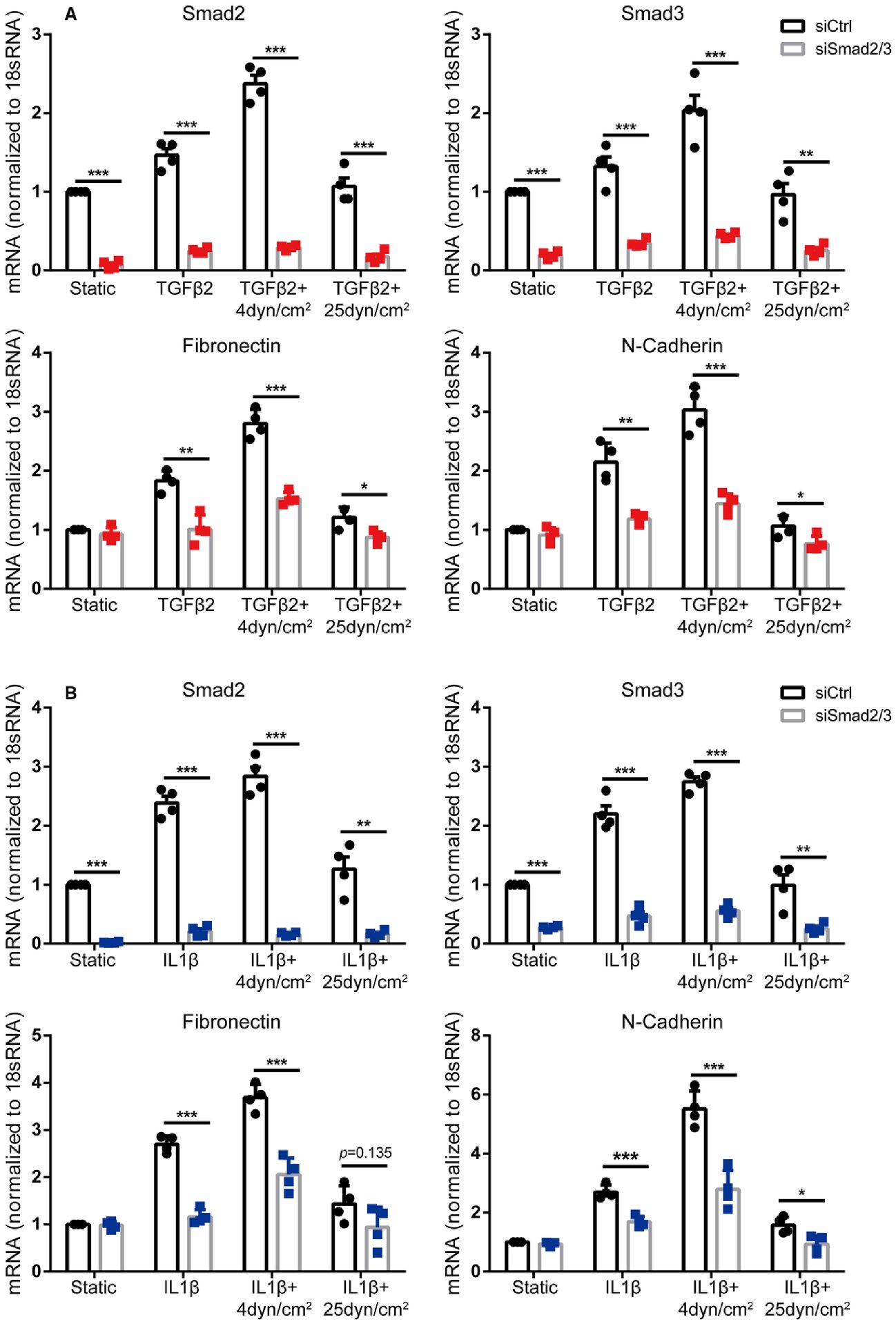
图3 Smad2/3敲低阻断TGFβ2或IL1β诱导的体外基因表达。
总之,该研究表明,低和振荡FSS增强,而高FSS抑制Smad2/3信号传导和间充质和炎症基因的表达,以响应TGFβ和炎性细胞因子(IL1β和TNFα)。因此,这些结果更新并扩展了高流量通过其对炎症途径的影响抑制动脉粥样硬化发生的主要模式,包括最近阐明的TGFβ-Smad2/3-EndMT机制。这些结果阐明了一种控制动脉粥样硬化病变部位选择性的新机制。低和紊乱的FSS通过细胞因子放大Smad2/3活化,而高FSS则有效抑制。因此,这些作用导致在血液流量低而趋于紊乱的区域优先形成动脉粥样硬化斑块,炎症和EndMT之间的正反馈促进疾病进展。
参考文献:Deng H, Schwartz MA. High Fluid Shear Stress Inhibits Cytokine-Driven Smad2/3 Activation in Vascular Endothelial Cells. J Am Heart Assoc. 2022 Jul 19;11(14):e025337. doi: 10.1161/JAHA.121.025337. Epub 2022 Jul 15. PMID: 35861829; PMCID: PMC9707828.
原文链接:https://pubmed.ncbi.nlm.nih.gov/35861829/
小编旨在分享、学习、交流生物科学等域的研究进展。如有侵权或引文不当请联系小编修正。
微信搜索公众号“Naturethink”,了解更多细胞体外仿生培养技术及应用。

新鲁汶大学的公报指出,如今抗生素耐药菌的出现给人类和医药带来了新 ...

根据“生物安全关键技术研发”重点专项评审工作安排,生物中心将于2 ...

2018年度国家科学技术奖提名工作已结束,国家科学技术奖励工作办 ...

为更好的向用户、潜在用户提供我们的产品,即日起推出如下活动:凡向 ...

据英国《自然·通讯》杂志日前发表的一篇医学论文报告,科学家发现了 ...

“免疫系统在高血压中扮演了未曾预料的重要角色。”英国格拉斯哥大学 ...

“来一场中国制造的品质革命!”3月5日,李总理在政府工作报告中发 ...

美国侨报网近日刊文称,一项新出炉的研究警告称,即使是失眠一夜,也 ...

我司自主研发产品,重视知识产权,已拥有多项专利证书! ...

Naturethink网站及微信内容逐步完善,敬请查阅! ...
公司完成细胞张应变与压力综合培养仪器的研发; ...

2018年春节将至,我司放假时间安排为:2月14日至2月21日, ...

为提高区域自主创新能力,推进区域科技创新体系建设,加大创新驱动区 ...

澳大利亚和英国一项研究显示,对于几乎任何年龄段的人群而言,快走都 ...

2018年国家自然科学基金项目申请工作已开始,你准备好了吗? ...
癌症在促进肿瘤表型表观遗传重编程和修饰的复杂组织微环境中发展。此 ...
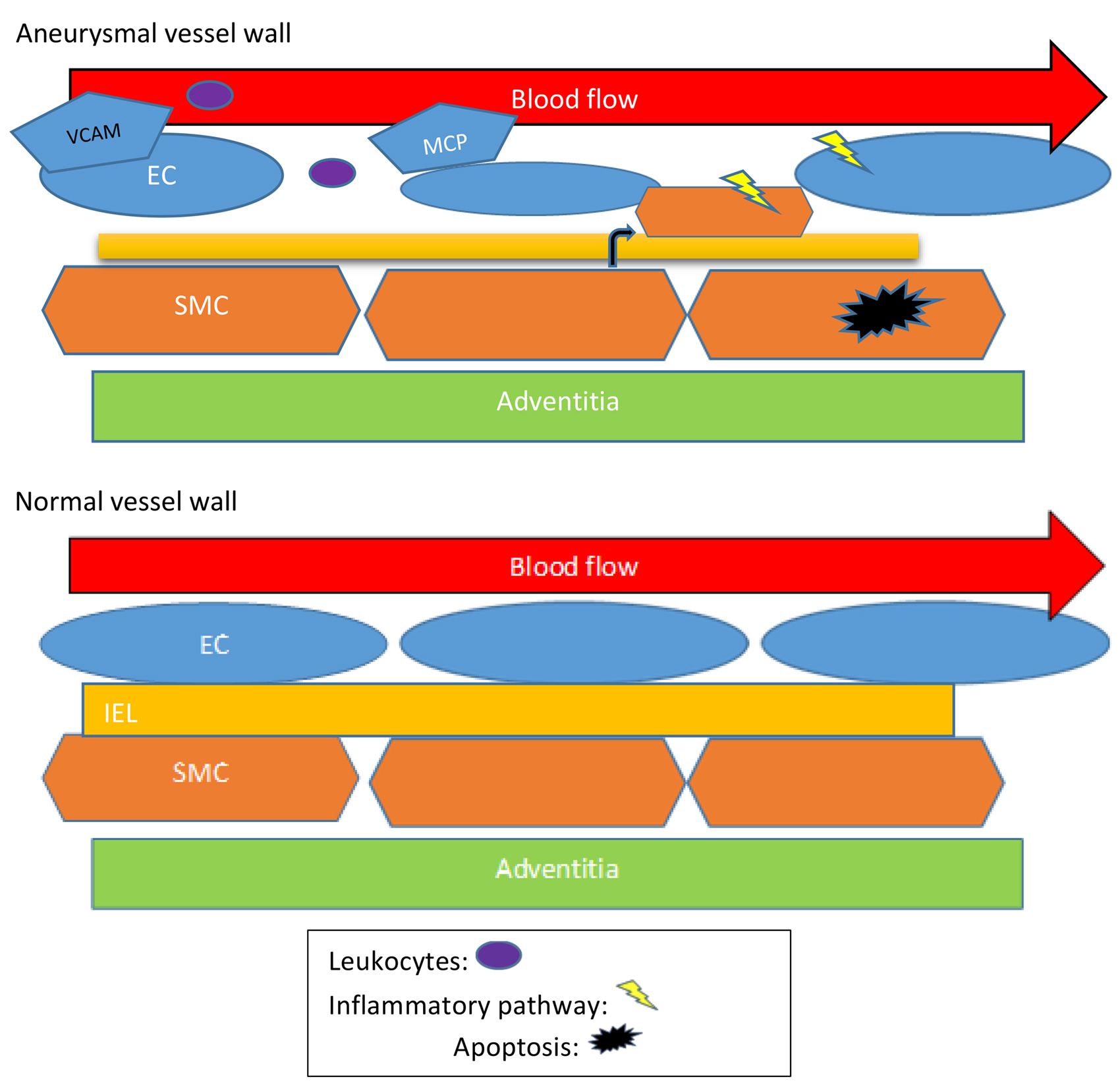
壁面剪切应力(WSS),是单位面积上由血管表面流动的液体产生的接 ...
炎症是机体受到外界微生物入侵后的一种保护性反应。作为影响最大的炎 ...