钠葡萄糖协同转运蛋白2抑制剂(SGLT2i)恩格列净(EMPA)已被批准用于治疗心力衰竭,因为它对伴和不伴糖尿病患者的心血管均有益处。EMPA 对心血管的保护作用可能部分解释为其对内皮细胞(ECs)的直接作用。
EMPA 在 ECs 中显示出强大的抗氧化作用。活细胞图像显示,在 TNF-α 刺激的静态人 ECs 中,EMPA 抑制 ROS 的产生并恢复 NO 生物利用度。最近,研究首次发现 SGLT2i 还能抑制暴露于10% 拉伸应力下的人冠状动脉内皮细胞(HCAECs)中 ROS 的产生和细胞通透性的增加,揭示了EMPA对动态培养的 ECs 也发挥保护作用。烟酰胺腺嘌呤二核苷酸磷酸氧化酶(NOX)1/4抑制剂 GKT136901 降低了 10% 拉伸应力下 ECs 中的 ROS,其程度与 EMPA 相似,且与 EMPA 联合使用时对 ROS 降低能力也不会增强,这支持 NOX 作为关键介质参与 EMPA 的抗氧化作用。
暴露于 TNF-α 和循环拉伸会增加 ECs 和心肌细胞中钠氢交换体(NHE)的活性,导致细胞内钠(Na+)增加。据推测,Na+ 通过钠钙交换体(NCX)增强胞质 Ca2+ 来触发 ECs 内 ROS 的产生,从而刺激 Ca2+ 依赖性蛋白激酶C(PKC)亚型。PKC 活性升高,尤其是 PKC-β,在人 ECs 的 NOX 活化和 ROS 产生中起主导作用。先前的研究表明,SGLT2i 直接抑制 NHE,并且用 EMPA 或 Cariporide(NHE抑制剂)降低 NHE 活性可抑制受到增强的拉伸和 TNF-α 刺激的人 ECs 中 ROS 的产生。然而,EMPA 对细胞内 Ca2+ 和 PKC 活性的影响在这些研究尚未调查。
最近,在荷兰阿姆斯特丹大学医学中心及德国石勒苏益格-荷尔斯泰因大学麻醉学与重症监护医学系联合课题组的一项研究中,假设 EMPA 通过阻止 PKC 激活来抑制拉伸诱导的 NOX 活化和 ROS 生成。研究人员旨在探讨PKC在拉伸刺激的 ECs 中参与 EMPA 降低 ROS 的作用,以及 EMPA 抑制 PKC 的上游信号通路。研究成果发表在 Redox Biology 期刊题为“Empagliflozin prevents oxidative stress in human coronary artery endothelial cells via the NHE/PKC/NOX axis”。

首先,将 HCAECs 暴露于4或24小时循环拉伸(1Hz)下,5% 的拉伸幅度作为生理对照,10% 幅度是损伤模型。与 5% 拉伸相比,10% 拉伸增加了 HCAECs 中的 PKC 活性(图1 B),1 μM EMPA 和 10 nM LY-333531(PKCβ 抑制剂)完全还原了 PKC 活性(图1 B )。EMPA 和 LY-333531 均可阻止 10% 拉伸下 HCAECs 中 NOX 活性,但两种药物的联合治疗不能增强这种活性(图1 C)。这些数据表明,EMPA 通过抑制 10% 拉伸下的 HCAECs 中的 PKC 活性来抑制 NOX 激活。
EMPA 和 LY-333531 均降低了 10% 拉伸诱导的 ROS 生成,联合处理无额外效果(图1 D)。LY-333531 恢复了 10% 拉伸后细胞 VE-钙黏蛋白的丢失和通透性的增加(图1 E、F)。免疫荧光染色显示,10% 的拉伸显著破坏了由VE-钙粘蛋白形成的细胞间连接,而 LY-333531 可以阻止这种破坏(图1 G)。这表明,EMPA 可以防止由 10% 拉伸引起的细胞通透性破坏。当 LY-333531 与 EMPA 联合使用时,其内皮保护作用没有进一步被放大,说明这两种化合物具有相似的保护机制(图1 E、F)。这些数据表明,EMPA 通过抑制 PKC 活性来降低 10% 拉伸下内皮细胞中增加的 ROS 生成和细胞通透性。
此外,10 nM PKC 激活剂 PMA 刺激了 5% 拉伸下 ECs 中 ROS 的产生,表明 PKC 是 HCAECs 中氧化应激的关键介质之一。GKT136901 的应用完全消除了 NOX 活性的增加,证明 NOX1/4 是促进拉伸下 ECs 中 NOX 活化的主要亚型。
以上数据表明,EMPA 通过抑制 PKC 活性改善拉伸诱导的内皮功能障碍。
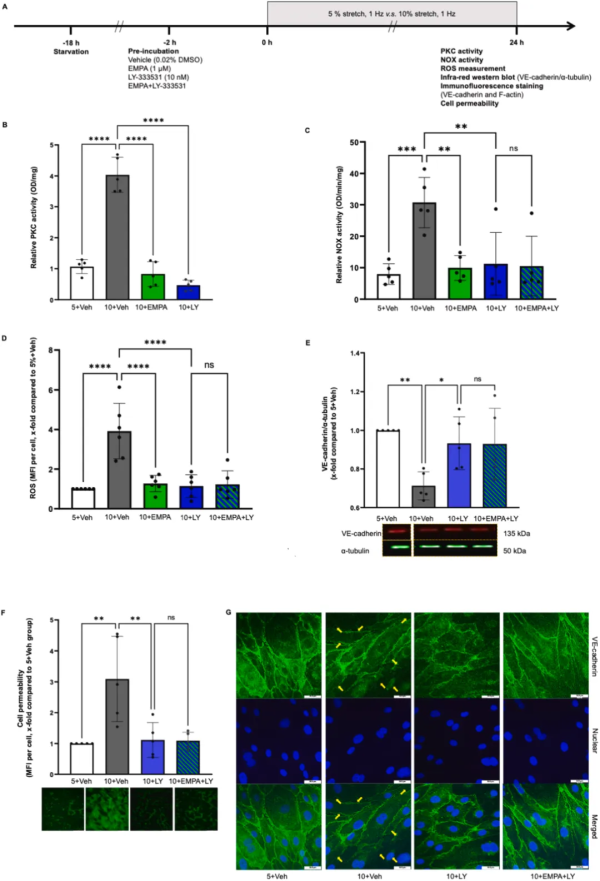
图1 EMPA通过抑制PKC活性减弱拉伸诱导的氧化应激和细胞通透性。
为了探究 HCAECs 中胞质 Ca2+ 和氧化应激的功能关系,应用 0.2 μM 离子霉素(IONO)增强细胞内 Ca2+,并激活内皮细胞中的PKC。使用特异性 siRNA 转染可使 PKC-β 表达降低 80%,这有效地消除了接受 IONO 的 HCAECs 中 NOX 活性和 ROS 产生的增加。此外,PKC-β 敲低阻断了 10% 拉伸下 NOX 的活化,表明 PKC-β 是拉伸相关氧化应激的介质。
在静态 HCAECs 中,EMPA、NCX 抑制剂 ORM-10962 和钙螯合剂 BAPTA-AM 降低了细胞内 Ca2+,EMPA 和 NCX 抑制剂 ORM-10962 的联合使用未导致 Ca2+ 的进一步降低(图2 A),表明 EMPA 可能通过抑制 NCX 在HCAECs 中降低 Ca2+。在暴露于 10% 拉伸的细胞中,BAPTA-AM 和 ORM-10962 都阻止了由 10% 拉伸诱导的增强的 PKC 活性和氧化应激(图2 C、D、E)。此外,BAPTA-AM 和 ORM-10962 都恢复了 10% 拉伸后增加的细胞通透性。BAPTA-AM 阻止了 10% 拉伸下 HCAECs 中 VE-钙粘蛋白的破坏,提示细胞内 Ca2+ 是拉伸相关内皮屏障功能障碍的中介。进一步验证 NCX1 作为拉伸相关 PKC 激活的中介作用,结果表明,NCX1的敲低阻止了由 10% 拉伸引起的 PKC 活性的增加。
上述数据表明,EMPA 可能会通过 NCX 降低细胞内 Ca2+,导致 10% 拉伸下 HCAECs 中的 PKC 活化和氧化应激的抑制。
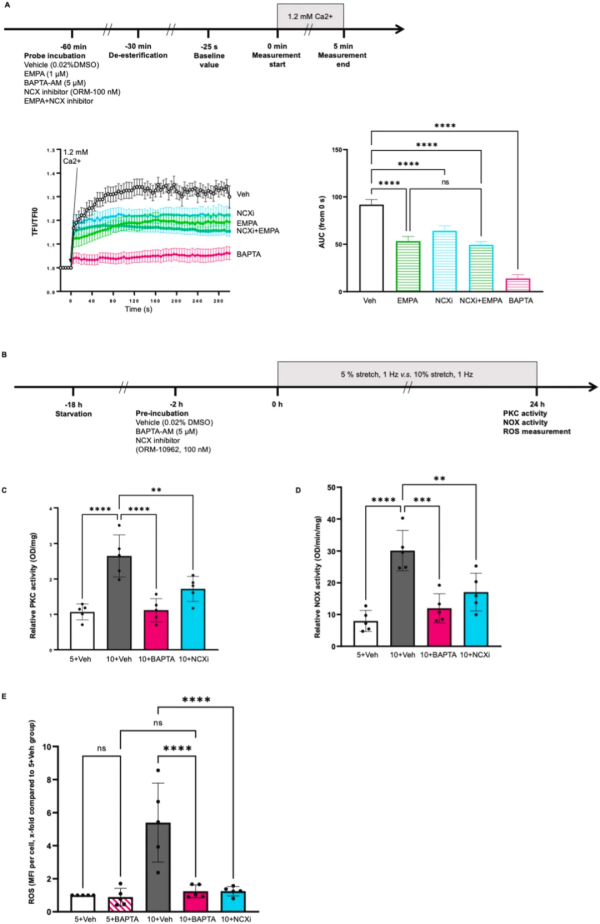
图2 EMPA可能会通过NCX 降低细胞内Ca2+,导致10% 拉伸下HCAECs中的PKC活化和氧化应激的抑制。
NHE 抑制剂 Cariporide 阻止了 10% 拉伸诱导的 PKC 活性增加,与 EMPA 联合使用时对 PKC 抑制作用没有增强。与单独使用 Cariporide 相比,和 EMPA 的联合对拉伸增强的 NOX 活性具有相似的抑制能力。进一步的实验表明,钠泵抑制剂哇巴因(ouabain)有效上调暴露于 5% 拉伸下 HCAECs 中 ROS 的产生。这表明,EMPA 通过抑制 NHE/Na+ 通路抑制拉伸诱导的 PKC 活性和 NOX 活化。
最后,实验研究了 HCAECs 中 EMPA 是否通过抑制 NHE 活性和减少胞质 Na+ 来降低细胞内 Ca2+ 。Cariporide 可降低静息 ECs 中 Ca2+ (图3 A),揭示了人 ECs 中 NHE 活性降低与细胞内 Ca2+ 降低之间的因果关系。令人惊讶的是,Cariporide 与 EMPA 的组合比单独使用 Cariporide 发挥了更有效的 Ca2+ 抑制作用。
为了探究 HCAECs 中 NHE1、胞质 Na+ 和 NCX1 在 Ca2+ 动员中的相互作用,在 Cariporide 或 Ouabain 存在下,在NCX1 敲低细胞中测量 Ca2+。NCX 敲低导致接受 Cariporide 的 HCAECs 中 Ca2+ 的进一步减少(图3 D),而 NHE 抑制剂没有降低 Ca2+。此外,NCX 敲低完全消除了由 Ouabain 引起的细胞内 Ca2+ 的增强(图3 E),表明累积的胞质 Na+ 通过 NCX 可以触发细胞内 Ca2+ 的增加。这些数据表明,EMPA 可能通过抑制 Na/NCX 轴降低胞质 Ca2+,这种作用部分由 NHE 介导。
值得注意的是,目前的研究显示 10% 拉伸或 EMPA 对 PKC-β、NOX4、NCX1 和 NHE1 的 mRNA 和蛋白质水平没有显著影响,这表明 EMPA 的内皮保护作用不是由这些基因表达的变化介导的。
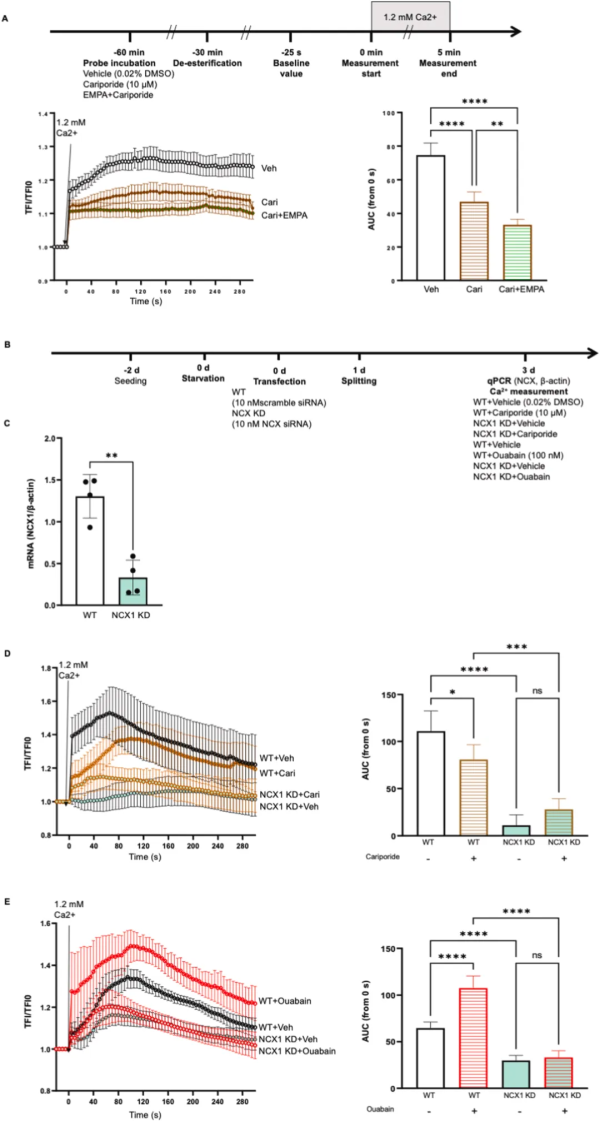
图3 EMPA通过Na+/NCX途径减少细胞内Ca2+,这部分是由NHE抑制介导的。
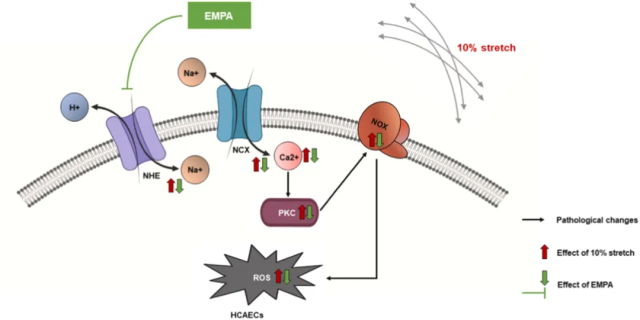
图4 结果概要。
EMPA通过抑制NHE/Na+/NCX轴降低细胞内Ca2+,进而阻止10% 拉伸诱导的PKC活性和NOX活化,并抑制ROS的产生。
总之,该研究证明了,在机械力作用下 HCAECs 中 EMPA 对 PKC 抑制的新作用,这也可能是解释观察到的 SGLT2i 对暴露于不同病理刺激(例如高血糖、炎症细胞因子、循环拉伸)的细胞的抗氧化作用的主要途径。使用机械激活的 HCAECs,研究进一步表明,EMPA 通过 NHE 和 NCX 等离子通道调节细胞内离子稳态(例如Na+ 和Ca2+)有助于改善内皮功能障碍。这些发现提高了关于 SGLT2i 对心血管益处的理解。
参考文献:Li X, Wang M, Kalina JO, Preckel B, Hollmann MW, Albrecht M, Zuurbier CJ, Weber NC. Empagliflozin prevents oxidative stress in human coronary artery endothelial cells via the NHE/PKC/NOX axis. Redox Biol. 2024 Feb;69:102979. doi: 10.1016/j.redox.2023.102979. Epub 2023 Dec 2. PMID: 38061206; PMCID: PMC10749278.
原文链接:https://pubmed.ncbi.nlm.nih.gov/38061206/
图片来源:所有图片均来源于参考文献
微信关注Naturethink公众号,了解更多相关信息。

新鲁汶大学的公报指出,如今抗生素耐药菌的出现给人类和医药带来了新 ...

根据“生物安全关键技术研发”重点专项评审工作安排,生物中心将于2 ...

为更好的向用户、潜在用户提供我们的产品,即日起推出如下活动:凡向 ...

2018年度国家科学技术奖提名工作已结束,国家科学技术奖励工作办 ...

据英国《自然·通讯》杂志日前发表的一篇医学论文报告,科学家发现了 ...

Naturethink祝愿伟大祖国繁荣昌盛,欣欣向荣! ...

“免疫系统在高血压中扮演了未曾预料的重要角色。”英国格拉斯哥大学 ...

“来一场中国制造的品质革命!”3月5日,李克强总理在政府工作报告 ...

我司自主研发产品,重视知识产权,已拥有多项专利证书! ...

美国侨报网近日刊文称,一项新出炉的研究警告称,即使是失眠一夜,也 ...
公司完成细胞张应变与压力综合培养仪器的研发; ...

Naturethink网站及微信内容逐步完善,敬请查阅! ...

为提高区域自主创新能力,推进区域科技创新体系建设,加大创新驱动区 ...

2018年春节将至,我司放假时间安排为:2月14日至2月21日, ...

澳大利亚和英国一项研究显示,对于几乎任何年龄段的人群而言,快走都 ...

2018年国家自然科学基金项目申请工作已开始,你准备好了吗? ...
壁面剪切应力(WSS),是单位面积上由血管表面流动的液体产生的接 ...
癌症在促进肿瘤表型表观遗传重编程和修饰的复杂组织微环境中发展。此 ...