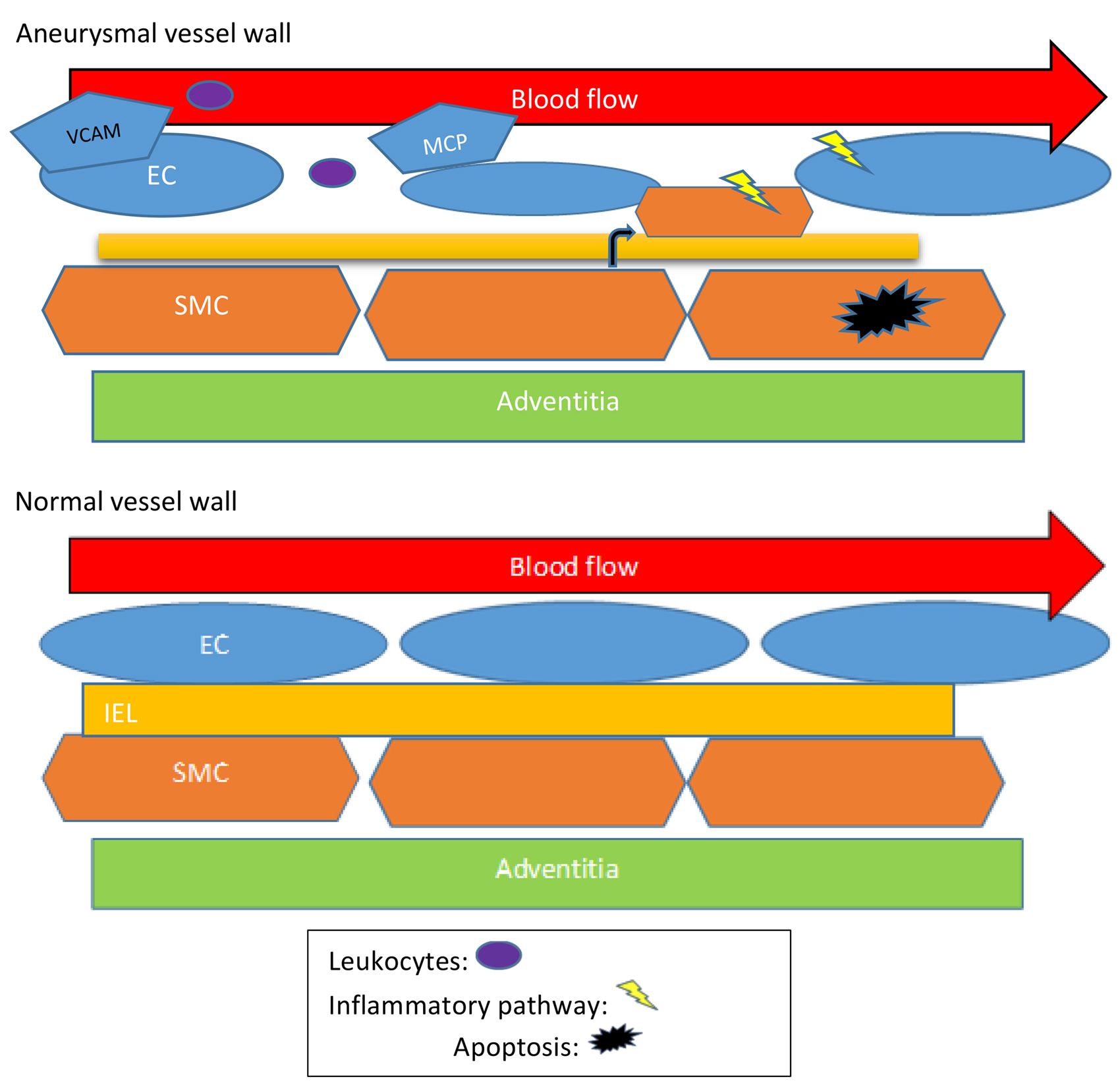
振荡流和单向血流可能对内皮细胞有不同的影响。很少有人研究过振荡剪切应力(OSS)的具体发病机制。有实验证据表明,与单向剪切应力相比,OSS 会在 24 小时内诱导 eNOS mRNA 和蛋白质数量的减少。然而,其生物力学和分子生物学机制尚不清楚。此外,很少研究振荡流在动脉粥样硬化进展中的可能作用。Toll 样受体(TLRs,先天免疫受体)被称为识别病原体相关分子模式的受体。研究表明,Toll 样受体 2(TLR2)可能作为一种重要的细胞表面机械传感器。TLR2 在内皮细胞中的表达与动脉粥样硬化的形成、发展和血管闭塞有关。转化生长因子激酶 1 (TAK1) 是丝裂原活化蛋白激酶激酶家族的成员,在功能上位于丝裂原活化蛋白激酶和 IKB 激酶的上游。实验表明,剪切应力可以通过降低 TAK1 的表达来保护内皮细胞。内皮细胞激活、功能障碍和损伤被认为是动脉粥样硬化发病机制中的关键初始事件。OSS、TLR2 和 TAK1 都以某种方式参与了动脉粥样硬化的发展。南京医科大学附属南京第一医院心内科的一项研究曾涉及 OSS 与 TLR2、TLR2 与 TAK1 的关系,旨在确定 OSS 是否会激活先天免疫反应,是否会引起内皮细胞的炎症变化,以及通过何种信号通路促进炎症。首先,实验证明了振荡流(4 dyne/cm2)在蛋白水平上可以促进内皮细胞中 TLR2 的表达,并且这种作用是时间依赖性的(0、15、30、60 和 120 min)。同时,在荧光实验中,TLR2 的荧光强度不断增加,这与 WB 的结果一致。接下来发现,OSS 还可以影响 HUVECs 中炎症和凋亡分子的表达。用 OSS 处理 ECs 不同时间段(0、15、30、60 或 120 min)。cleaved-caspase3 的表达水平持续上升。如图2 B 进行 RT-PCR,发现 OSS 可以在 mRNA 水平上增加 ICAM-1 和 VCAM-1 的表达。NF-kappa B 激酶 (IKK) 抑制剂在先天性免疫和适应性免疫中起重要作用,并参与细胞凋亡、炎症和坏死。如图2 C,OSS 激活了 IKK2 的磷酸化,并且磷酸化水平随着刺激的时间而增加。如图2D,OSS 以时间依赖性方式显著诱导蛋白质表达。流式细胞仪和 TUNEL 进一步验证 OSS 是否可以增加内皮细胞的凋亡(图2 E、F)。为了探索 TAK1、IKK2 和 TLR2 之间的关系,实验采用 TLR2 特异性 siRNA 来降低 TLR2 的表达并观察其表达的变化。将细胞暴露在静止、高剪切应力(HSS)或 OSS 条件下一个小时。结果发现 OSS 可以增加 TLR2、TAK1 和 p-IKK2 的量。然而,在用 TLR2 siRNA 转染的细胞中,TAK1 表达和 IKK 磷酸化水平的增加被抑制。这一发现表明 TAK1 和 IKK2 受 TLR2 的调节。免疫荧光实验表明,当 TLR2 的表达降低时,在 OSS 的作用下 TAK1 的荧光强度也随之降低。接下来应用 TLR2 抑制剂 CU CPT,得到了相同的结果。至此可以得出结论,在 OSS 下 TLR2 在 TAK1 和 IKK2 上游起作用。在用 TLR2 siRNA 转染后,OSS 对 ROS、ICAM-1 和 VCAM-1 的上调作用可以减弱或消除最后为了进一步阐明 TAK1 的作用,用 TAK1 siRNA 转染内皮细胞。结果表明,通过 TAK1 siRNA 转染,OSS 诱导的 p-IKK2 上调显著减弱,p-IKK2 的荧光强度也降低。接下来通过 TAK1 的抑制剂 5O-7Z 获得了相同的结果。根据上述结果得出结论,在 OSS 的影响下,TAK1 位于 IKK2 的上游。然后为了确定 TAK1、IKK2 和 TLR2 之间是否存在相互作用,用 TAK1 和 IKK2 siRNA 转染内皮细胞。当 TAK1 和 IKK2 的表达下降时,TLR2 的表达没有变化。实验还发现 OSS 通过 IKK2 促进内皮细胞凋亡,但可能不是通过 TAK1。用 TAK1 或 IKK2 SiRNA 转染后,OSS 对 ICAM-1 和 VCAM-1 的上调减弱。
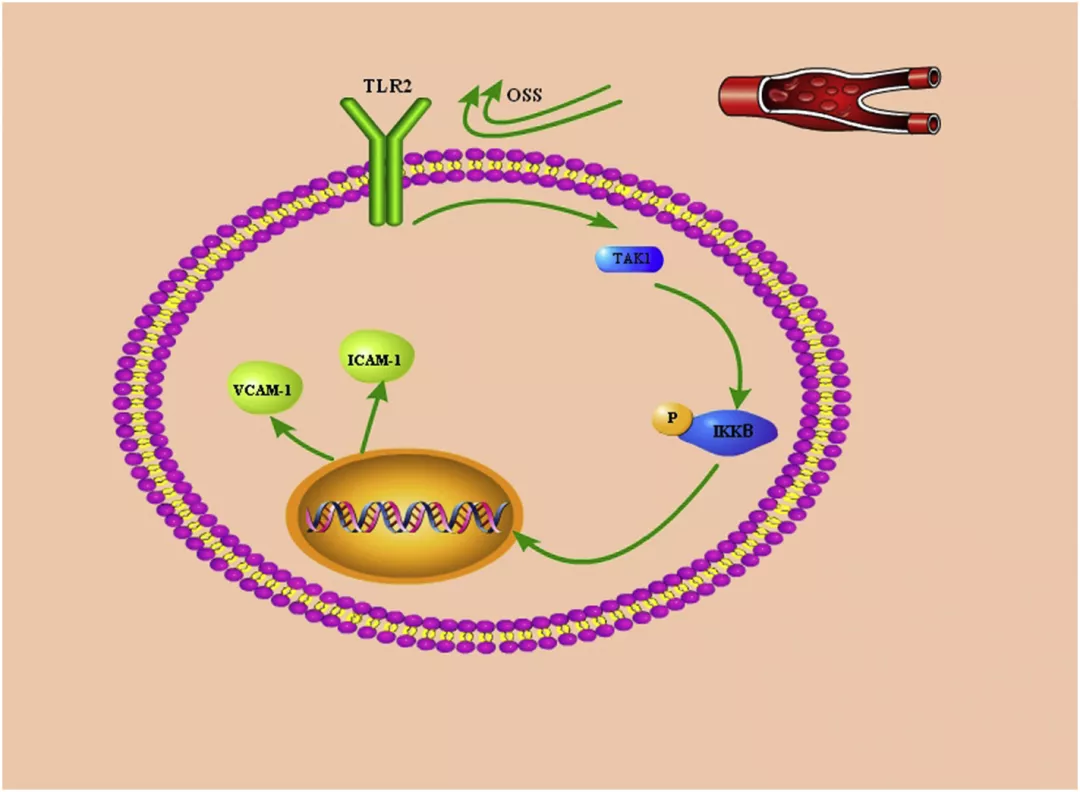
图1 振荡流通过 TLR2-TAK1-IKK2 信号通路促进炎症反应。总之,该结果表明 OSS 以 TAK1 和 IKK2 依赖性方式激活 TLR2 并诱导 ICAM-1 和 VCAM-1 表达(图5)。OSS 通过激活 TLR2 和 TAK1 增加细胞内活性氧的形成。这是第一项评估 OSS 与免疫系统重要分子 TLR2 之间因果关系的研究。实验结果不仅反映了剪切应力与免疫信号之间的关系,而且暗示了支架再狭窄中振荡流的分子机制。参考文献:Wang F, Wang Z, Pu J, Xie X, Gao X, Gu Y, Chen S, Zhang J. Oscillating flow promotes inflammation through the TLR2-TAK1-IKK2 signalling pathway in human umbilical vein endothelial cell (HUVECs). Life Sci. 2019 May 1;224:212-221. doi: 10.1016/j.lfs.2019.03.033. Epub 2019 Mar 23. PMID: 30914314.原文链接:https://pubmed-ncbi-nlm-nih-gov.proxy.library.carleton.ca/30914314/小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。关注公众号Naturethink了解更多科研资讯!
标签: