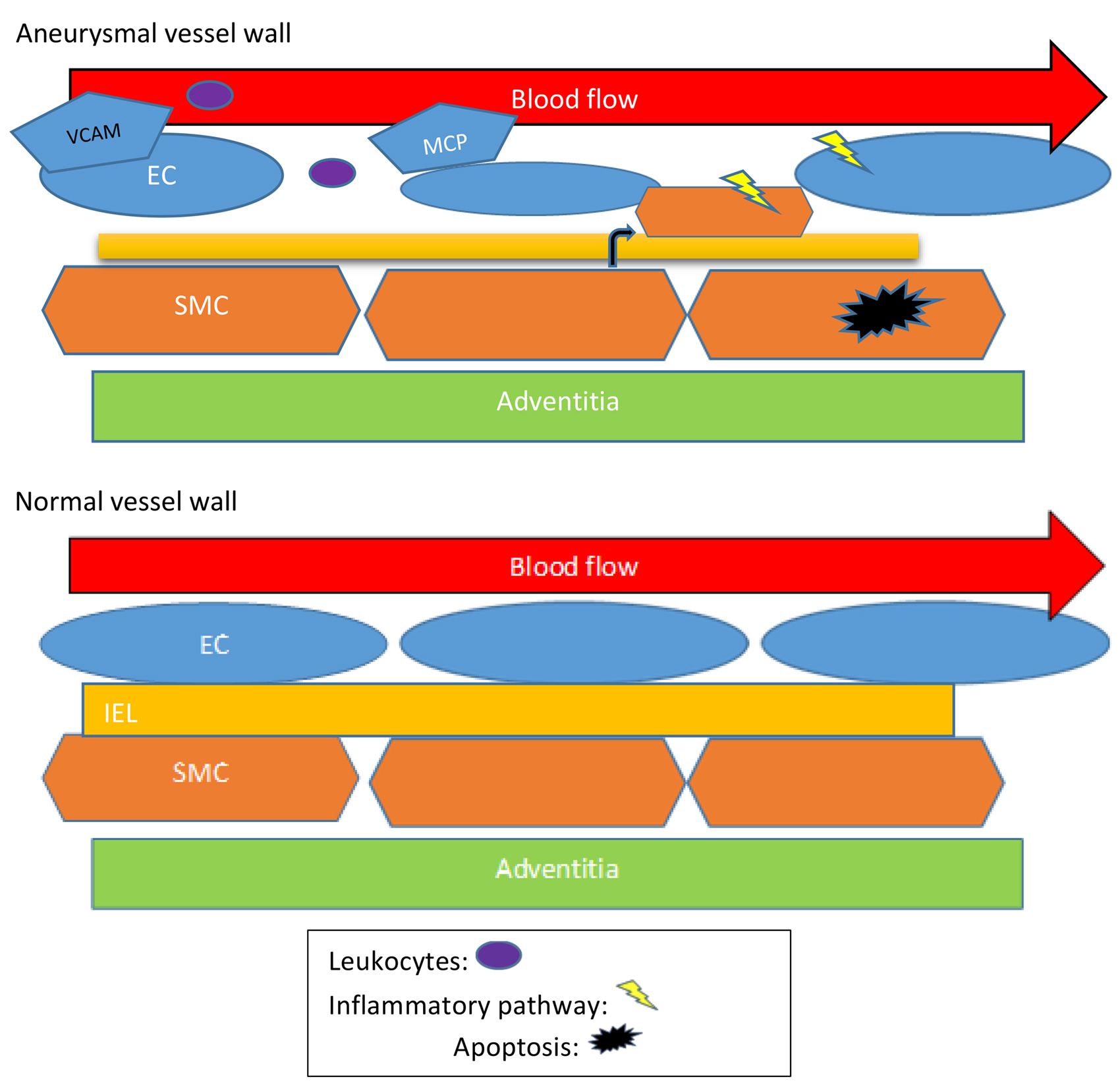
内皮细胞(EC)暴露于血管腔内的变化,如机械损伤,剪切应力或化学试剂。在这些情况下,EC释放各种细胞因子、趋化因子和生长因子,导致内皮功能障碍表型,并引发心血管疾病的进展,如高血压、动脉粥样硬化、糖尿病等。在血管壁的中层,血管平滑肌细胞(VSMCs)是主要组成成分,表现出高度的可塑性,具有两种不同表型,即分化表型(收缩表型)和去分化表型(合成表型)。这些表型修饰调节VSMCs的增殖、迁移和炎症能力,在动脉重塑中起主要作用。内膜层的EC与中层的VSMC之间的通讯是病理性血管重塑开始和进展的关键步骤。例如,EC-VSMC通讯中的扰动可导致动脉粥样硬化发展的典型特征,如内皮功能障碍、炎性细胞浸润或VSMCs表型转换。
血管壁重塑是指血管壁对生物化学和生物力学刺激的适应。这种重塑是一个活跃的过程,涉及VSMCs增殖和迁移状态的变化、内皮功能障碍、炎症过程以及细胞外基质(ECM)成分的合成或降解。所有这些过程都受到生长因子、血管活性物质和细胞间血流动力学刺激的动态相互作用的调控,从而引发血管壁结构和功能的变化。血管结构和组成的这些病理变化可能导致血管疾病和循环系统疾病的病理过程,并引起临床表现。确定在血管重塑过程中介导血管稳态的EC-VSMC相互作用的通路可能为心脑血管疾病(CVD)预防提供见解。
在西班牙希门尼斯·迪亚兹大学医院基金会和心血管疾病研究网络联合团队的一项文章中曾总结了细胞间通讯的不同通路以及不同的体外模型来分析EC-VSMCs的相互作用。

EC和VSMCs之间的细胞间通讯不仅在血管稳态中而且在疾病中也起着关键作用。血管对生理和病理刺激的反应部分取决于管腔侧内层的EC与血管壁内VSMC之间的串扰。因此,这证实了血管病理生理学的体外分析需要EC和VSMCs共培养系统的原因。但是目前尚不清楚EC-VSMC物理或旁分泌相互作用的缺陷,或其微环境(细胞外基质)如何导致CVD,这将有助于确定诊断或治疗血管重塑疾病的关键参与者。
一、Paracrine Communications(旁分泌通讯)
1.可溶性因子
可溶性因子的扩散及其浓度之间的平衡是成熟血管EC-VSMCs通讯中必不可少的过程。与单独培养的VSMCs相比,EC中的一些可溶性因子具有改变VSMCs的低密度脂蛋白代谢或降低胆固醇酯水解的能力。
EC中的一氧化氮(NO)似乎调节VSMCs中醛糖还原酶的代谢活性,并防止糖尿病大鼠主动脉的山梨糖醇积累。此外,一氧化碳(CO)与NO 在EC-VSMCs串扰中的血管舒张作用间接相关。瞬时HO-1/CO- 通过ECs中eNOS/NO轴的上调来调节血管张力,随后增加VSMCs中的cGMP产生。EC和VSMC内的适应性自噬已被描述为维持血管重塑疾病和心脏微血管系统中血管功能的重要机制。串扰研究报道,ECs还会释放其他因子,例如血管紧张素II或内皮素,与VSMCs的收缩和血管张力增加有关。血小板衍生生长因子(PDGF)是众多生长因子中的另一种,它们在生理或病理情况下基本上与EC-VSMCs通讯有关。在胚胎发育过程中,内皮细胞-PDGF参与VSMCs的募集、增殖和迁移,这些都是形成血管壁所必需的。鞘氨醇-1-磷酸(S1P)通路是另一个参与EC和VSMC之间旁分泌通讯的受体-配体轴。已经表明,在EC和VSMC的人类共培养模型中,EC上S1P1受体的缺失会导致VSMCs覆盖率的显著缺陷。此外,雷帕霉素(mTOR)的哺乳动物靶标的数据代表了EC-VSMCs串扰的另一个层次,这支持了共培养实验的必要性,以获得病理学的整体视野。
2.细胞外囊泡
细胞外囊泡(EVs)的分泌是血管稳态或病理性血管重塑期间发生细胞间通讯的重要机制。在EC-VSMC的相互作用方面,研究表明EC和VSMCs释放细胞外囊泡,这可能与血管稳态或病理进展有关。在生理情况下,正常的层流触发含有miR-143和miR-145的细胞外微泡。EC将miR143/145包装并释放到外泌体中,外泌体被邻近的VSMCs吸收,有助于调节这些细胞中的表型靶基因。miR-143/miR-145也被证明可靶向与VSMCs分化调节有关的其他关键转录调控因子,例如含ETS结构域的蛋白-1(ELK-1)和心肌素。
二、Parenchyma Players(通过细胞外基质(ECM)相互作用)
细胞通讯也可以通过细胞外基质(ECM)的特性进行。ECM的改变不仅会导致结构改变,还可能导致EC-VSMCs信号转导中断。ECs和VSMCS都分泌基质成分,有助于维持血管特性并影响邻近细胞功能。在ECM成分中,胶原蛋白是促成血管壁几何变化的主要分子,其沉积有利于提高血管硬度,并可用于将VSMC和EC的基底膜与其他ECM结构连接起来。此外,虽然胶原蛋白I和纤连蛋白诱导合成VSMCs表型,但细胞分泌IV型胶原可促进收缩性VSMCs表型信号转导。
三、Contact-Contact Signaling
1.肌内皮缝隙连接
研究最多的细胞间接触称为肌内皮缝隙连接(MEGJ)。功能性缝隙连接的形成需要连接蛋白(Cx)的组装。在血管系统中,Cx37、Cx40、Cx43和Cx45是主要的连接蛋白。从本质上讲,MEGJ作为VSMCs和EC之间的反馈通路,以促进离子或小分子的直接转移,主要是第二信使,如Ca2+、IP3和cAMP或EDH信号,以控制血管收缩-舒张。
2.Notch信号
强有力的证据已经证明了Notch信号在EC-VSMCs串扰中的作用。EC和VSMCs都普遍表达Notch元素。然而,Notch元素会根据细胞阶段和细胞类型而发生变化。Notch在EC-VSMCs通讯中的主要功能部分是由Jagged1配体驱动的。内皮Notch激活的改变也与动脉粥样硬化中的保护作用有关,并且在控制血管损伤中VSMCs表型转换中起重要作用。此外,研究还显示了EC-VSMC串扰中Notch信号传导在动脉粥样硬化纤维帽形成中的作用。
研究血管重塑过程中EC-VSMCs通讯的体外模型
了解血管重塑疾病中的EC-VSMCs通讯的重要性导致了在开发相关体外模型方面的巨大努力。必须创建一个EC-VSMC共培养模型,在该模型中可以概括血流动力学,环境或结构,尝试模仿体内血管壁环境。生成通用且稳定的EC-VSMCs共培养体外模型的必要性被认为是未来研究和转化药物筛选的必要和关键。共培养的类型可分为:
1.间接共培养
在没有物理接触的情况下,研究细胞-细胞依赖性相互作用的体外模型,并基于分泌通路和旁分泌通讯。微载体、支架、双分子层膜、使用条件培养基(CM)或 transwell assay 是间接共培养的例子。在该模型中,细胞是分开生长的,其中一个细胞的培养基用于刺激另一种细胞类型。然而,单向响应和可溶性因子是唯一没有细胞-细胞相互作用的介质,是该模型的一些缺点。该模型也已扩展到与动脉粥样硬化相关的不同研究中。
二维(2D)细胞培养EC-VSMCs(transwells,flow chambers)。该方法已被广泛使用,其优点是技术简单,同时能够进行显微镜检查,并且无需细胞分选即可轻松分离纯群体。简而言之,该方法包括在平板底部培养一种细胞类型,另一种在膜过滤器上培养,可防止细胞间接触,也有该模型的变体允许在滤膜的不同侧进行细胞培养。此外,膜孔径的可变性允许在某些情况下ECs和VSMCs之间的相互作用,并允许这种体外模型用于血管重塑研究,以评估迁移,免疫细胞跨内皮细胞,通透性研究或细胞间旁分泌调节。
2.直接共培养
间接共培养的主要局限性是缺乏由血管壁中细胞-细胞接触。3D模型的情况并非如此。3D共培养模型的不同变体可以允许人们研究之前描述的三种主要类型的细胞相互作用:细胞-细胞接触,旁分泌相互作用和细胞-ECM相互作用,使这些模型在生理上与研究病理和生理血管重塑更相关。3D共培养系统的一些例子是:EC-VSMCs球体,包括EC和VSMCs的直接培养,或EC在含有VSMCs(胶原支架)的细胞外基质样凝胶上的培养,以及由诱导多能干细胞(IPs)产生的血管类器官。
尽管这些体外临床前研究最终可以使用,但不幸的是,在许多情况下未能将其转化为临床疗效,这表明需要新的临床前系统。体外建模复杂性的下一步是3D人源性血管类器官。这些体外3D人体血管类器官是通过自组织形成的,并表现出人微血管系统的形态、功能和分子特征。该系统已被用于概括人体血管的结构和功能,以研究血管疾病的调节因子,如糖尿病。未来,类器官的应用将为药物筛选的新方法打开大门。

图1 EC-VSMCs在血管壁的通讯。示意图:旁分泌,细胞外囊泡,ECM和直接细胞间相互作用。EC-VSMC通讯的失调触发与某些CVD相关的病理性血管壁重塑。
血管壁细胞之间的通讯是血管系统正确形成和功能的基础。在这篇综述中,总结了物理或旁分泌EC-VSMCs通讯如何产生血管床特异性特征的,以及这种串扰的变化如何成为病理性血管重塑的主要原因(图1)。因此,进一步的研究应旨在加强目前对VSMCs和EC在共培养模型中相互作用的理解。这可以提供有关血管稳态的主要知识来源,以便找到预防血管重塑进展的新疗法。
参考文献:Méndez-Barbero N, Gutiérrez-Muñoz C, Blanco-Colio LM. Cellular Crosstalk between Endothelial and Smooth Muscle Cells in Vascular Wall Remodeling. Int J Mol Sci. 2021 Jul 6;22(14):7284. doi: 10.3390/ijms22147284. PMID: 34298897; PMCID: PMC8306829.
原文链接:https://pubmed.ncbi.nlm.nih.gov/34298897/
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。
微信搜索公众号“Naturethink”,了解更多细胞体外仿生培养技术及应用。

新鲁汶大学的公报指出,如今抗生素耐药菌的出现给人类和医药带来了新 ...

根据“生物安全关键技术研发”重点专项评审工作安排,生物中心将于2 ...

为更好的向用户、潜在用户提供我们的产品,即日起推出如下活动:凡向 ...

2018年度国家科学技术奖提名工作已结束,国家科学技术奖励工作办 ...

据英国《自然·通讯》杂志日前发表的一篇医学论文报告,科学家发现了 ...

Naturethink祝愿伟大祖国繁荣昌盛,欣欣向荣! ...

“免疫系统在高血压中扮演了未曾预料的重要角色。”英国格拉斯哥大学 ...

“来一场中国制造的品质革命!”3月5日,李克强总理在政府工作报告 ...

我司自主研发产品,重视知识产权,已拥有多项专利证书! ...

美国侨报网近日刊文称,一项新出炉的研究警告称,即使是失眠一夜,也 ...
公司完成细胞张应变与压力综合培养仪器的研发; ...

Naturethink网站及微信内容逐步完善,敬请查阅! ...

为提高区域自主创新能力,推进区域科技创新体系建设,加大创新驱动区 ...

2018年春节将至,我司放假时间安排为:2月14日至2月21日, ...

澳大利亚和英国一项研究显示,对于几乎任何年龄段的人群而言,快走都 ...

2018年国家自然科学基金项目申请工作已开始,你准备好了吗? ...
壁面剪切应力(WSS),是单位面积上由血管表面流动的液体产生的接 ...
癌症在促进肿瘤表型表观遗传重编程和修饰的复杂组织微环境中发展。此 ...