机械力是正常细胞功能不可或缺的一部分,其破坏会导致体内平衡的丧失。尽管已知骨骼对机械负荷有反应,但人们对骨骼稳态机械调节的分子机制知之甚少。
无处不在表达的衔接分子 p130Cas(Crk 相关底物,以下称为 Cas)在细胞外基质参与后在粘着斑处磷酸化,参与各种细胞过程,包括迁移、存活、转化和侵袭。之前已经证明 Cas 通过力依赖的构象变化而起到独立于离子通道的细胞骨架机械传感器的作用。然而,目前尚不清楚 Cas 是否参与了体内机械力的反应。
核因子 κB (NF-κB) 是一种转录因子,在调节炎症和衰老中起着核心作用。因为 NF-κB 可以普遍表达并据报道称具有机械响应性,所以可以推测 Cas 可能与 NF-κB 在与炎症和衰老相关的机体稳态的机械调节中相互作用。
间质液分布在所有动物的整个身体中,由大部分细胞外液组成,其体积约为循环血浆的四倍。骨骼是一个新陈代谢活跃的器官,正在进行不断的重塑,它不是完全的固体,而是一个含有间质液体的可变形的多孔体。
骨细胞是成熟骨骼中最常见的细胞。在板层骨中,骨细胞及其高度互连的树突状突起分别位于称为腔隙和小管的空间内。由机械负荷引起的骨骼变形会在腔隙小管系统中产生间质液流动,从而对骨细胞产生剪切应力。
基于此,由来自新加坡国立大学机械生物学研究所、日本东京都老年医院等在内的多所机构进行了合作研究,于Science Advances 发表了研究论文。研究人员假设骨细胞中的 Cas-NF-κB 相互作用可能参与骨稳态的机械调节。

实验结果:
为了验证关于 Cas 和 NF-κB 在骨代谢中的机械作用的假设,实验使用了小鼠骨卸载模型,其中每只小鼠的一个后肢接受坐骨神经和股神经切除术,而另一个暴露进行假手术作为对照。与对侧对照相比,卸载的股骨表现出显著的骨体积减少。
出乎意料的是,相当比例的 Cas 分布在对照骨的骨细胞核中,而大多数 Cas 分布在卸载骨的胞质中。此外,与 NF-κB 活性相关的 RelA 乙酰化,与对侧对照相比,在卸载胫骨的骨细胞中增加。值得注意的是,RelA 在骨细胞中的核分布没有因卸载而发生显著改变。
总之,机械负荷依赖性 Cas 核分布与骨细胞核中的 RelA 乙酰化呈负相关。这些体内研究结果表明,Cas 和 NF-κB 可能参与先前报道的骨细胞的机械感觉功能,并有助于机械负荷相关的骨稳态。
模拟研究表明,骨细胞暴露于峰值为 0.8-3 Pa 的流体剪切应力 (FSS),这是由于机械载荷作用于骨产生的小管间质液流动引起的。虽然在静态条件下生长的 MLO-Y4 骨细胞中 Cas 的核分布似乎很小,但在应用脉冲 FSS(平均 1 Pa,1 Hz)10 分钟后,Cas 显著增加,甚至在 FSS 终止后 24 小时仍保持增加。
相比之下,应用 FSS 后 RelA 乙酰化降低,并持续降低至少24 小时(图1 E)。此外,当 Cas 表达在 MLO-Y4 骨细胞中被逆转录病毒沉默时(图1 F),FSS并没有降低,而是增加了RelA乙酰化(图1 G,比较2道和4道,图1 H)。
这些结果表明,在体外骨细胞中,Cas通过核易位介导剪切应力诱导的RelA乙酰化衰减。
接下来,实验研究确定 Cas 和 NF-κB 是否在体内调节骨细胞功能中发挥生理作用,结果表明 Cas 主要通过调节骨细胞NF-κB配体受体激活因子(RANKL)表达来控制破骨细胞骨吸收。
此外,为了检查骨细胞特异性Cas条件敲除小鼠(Cas cKO)中表现出的骨质流失是否与机械调节有关,进行了机械卸载实验。与对侧对照组相比,未卸载的对照组小鼠骨体积显著减少,骨吸收参数显著增加。尽管Cas cKO 小鼠的卸载后肢骨量显著减少,但与对照小鼠相比,卸载对骨量的影响程度适中且不那么显著。值得注意的是,没有观察到Cas cKO 小鼠的对照组和卸载骨组之间的骨吸收参数存在显著差异。
在对照组小鼠中,与来自对侧对照组的小鼠相比,由卸载骨制备的骨细胞分数中的 RANKL mRNA 表达增加。然而,无论卸载与否,Cas cKO 小鼠的骨细胞分数中的 RANKL 表达都得到了增强。
在对照组和Cas cKO 小鼠中,很可能是卸载后骨形成减少,导致骨体积减少(图2 A)。尽管在对照组和Cas cKO 小鼠中观察到骨形成参数降低的相似趋势,但由于每个参数的变异性很大,无法在对照组和Cas cKO小鼠中检测到显著差异。
与体内实验结果一致,应用 FSS 后 24 小时,MLO-Y4 骨细胞中的 RANKL 表达降低,而在敲除Cas 的骨细胞中RANKL 显著上调与 FSS 无关。
这些发现表明,骨细胞中的 Cas 在机械负荷诱导的 RANKL 介导的骨吸收减少中起重要作用。
然后,实验检查了 Cas 是否参与了卸载骨的骨细胞中 RelA 乙酰化的增加。与在第一组小鼠中的观察结果一致,与对照组Casflox/flox小鼠的对侧骨细胞相比,卸载胫骨的骨细胞中 Cas 核分布减少,RelA 乙酰化增加。然而,无论卸载与否,Cas cKO 小鼠的RelA 乙酰化均增强,而非核分布增强。这表明 Cas 参与了骨细胞中 RelA 乙酰化的机械负荷依赖性降低,支持了Cas-NF-κB 相互作用的生理相关性。
最后,实验还证明 Cas 负向调节 RelA 乙酰化,而RelA乙酰化又通过增加骨细胞内ROS水平来控制RANKL的表达;Cas通过干扰细胞核中的RelA-p300/CBP相互作用下调NF-κB活性;Cas-NF-κB 相互作用,通过骨细胞中的 RANKL 表达在骨吸收中发挥生理作用。
实验结论:
在这里,实验证明 Cas 分布在细胞核中,并通过减轻 NF-κB 活性来支持机械负荷介导的骨稳态,否则会引发炎症过程。机械卸载调节骨细胞(骨骼中的机械感觉细胞)中的 Cas 分布和 NF-κB 活性。骨细胞中的 Cas 缺乏会增加与 NF-κB 介导的 RANKL 表达相关的破骨吸收,导致骨质减少。在对培养的骨细胞施加剪切应力后,Cas 易位到细胞核中并下调 NF-κB 活性。
总的来说,流体剪切应力依赖于 Cas 介导的 NF-κB 活性的减轻来支持骨稳态。鉴于 Cas 和 NF-κB 的普遍表达以及间质液的全身分布,Cas-NF-κB 的相互作用也可能支持其他组织和器官的调控机制。
参考文献:Miyazaki T, Zhao Z, Ichihara Y, Yoshino D, Imamura T, Sawada K, Hayano S, Kamioka H, Mori S, Hirata H, Araki K, Kawauchi K, Shigemoto K, Tanaka S, Bonewald LF, Honda H, Shinohara M, Nagao M, Ogata T, Harada I, Sawada Y. Mechanical regulation of bone homeostasis through p130Cas-mediated alleviation of NF-κB activity. Sci Adv. 2019 Sep 25;5(9):eaau7802. doi: 10.1126/sciadv.aau7802. PMID: 31579816; PMCID: PMC6760935.
原文链接:https://pubmed-ncbi-nlm-nih-gov.proxy.library.carleton.ca/31579816/
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。如有任何的想法以及建议,欢迎联系小编。感谢各位的浏览,更多资讯请关注公众号 Naturethink!

新鲁汶大学的公报指出,如今抗生素耐药菌的出现给人类和医药带来了新 ...

根据“生物安全关键技术研发”重点专项评审工作安排,生物中心将于2 ...

为更好的向用户、潜在用户提供我们的产品,即日起推出如下活动:凡向 ...

2018年度国家科学技术奖提名工作已结束,国家科学技术奖励工作办 ...

据英国《自然·通讯》杂志日前发表的一篇医学论文报告,科学家发现了 ...

Naturethink祝愿伟大祖国繁荣昌盛,欣欣向荣! ...

“免疫系统在高血压中扮演了未曾预料的重要角色。”英国格拉斯哥大学 ...

“来一场中国制造的品质革命!”3月5日,李克强总理在政府工作报告 ...

我司自主研发产品,重视知识产权,已拥有多项专利证书! ...

美国侨报网近日刊文称,一项新出炉的研究警告称,即使是失眠一夜,也 ...
公司完成细胞张应变与压力综合培养仪器的研发; ...

Naturethink网站及微信内容逐步完善,敬请查阅! ...

为提高区域自主创新能力,推进区域科技创新体系建设,加大创新驱动区 ...

2018年春节将至,我司放假时间安排为:2月14日至2月21日, ...

澳大利亚和英国一项研究显示,对于几乎任何年龄段的人群而言,快走都 ...

2018年国家自然科学基金项目申请工作已开始,你准备好了吗? ...
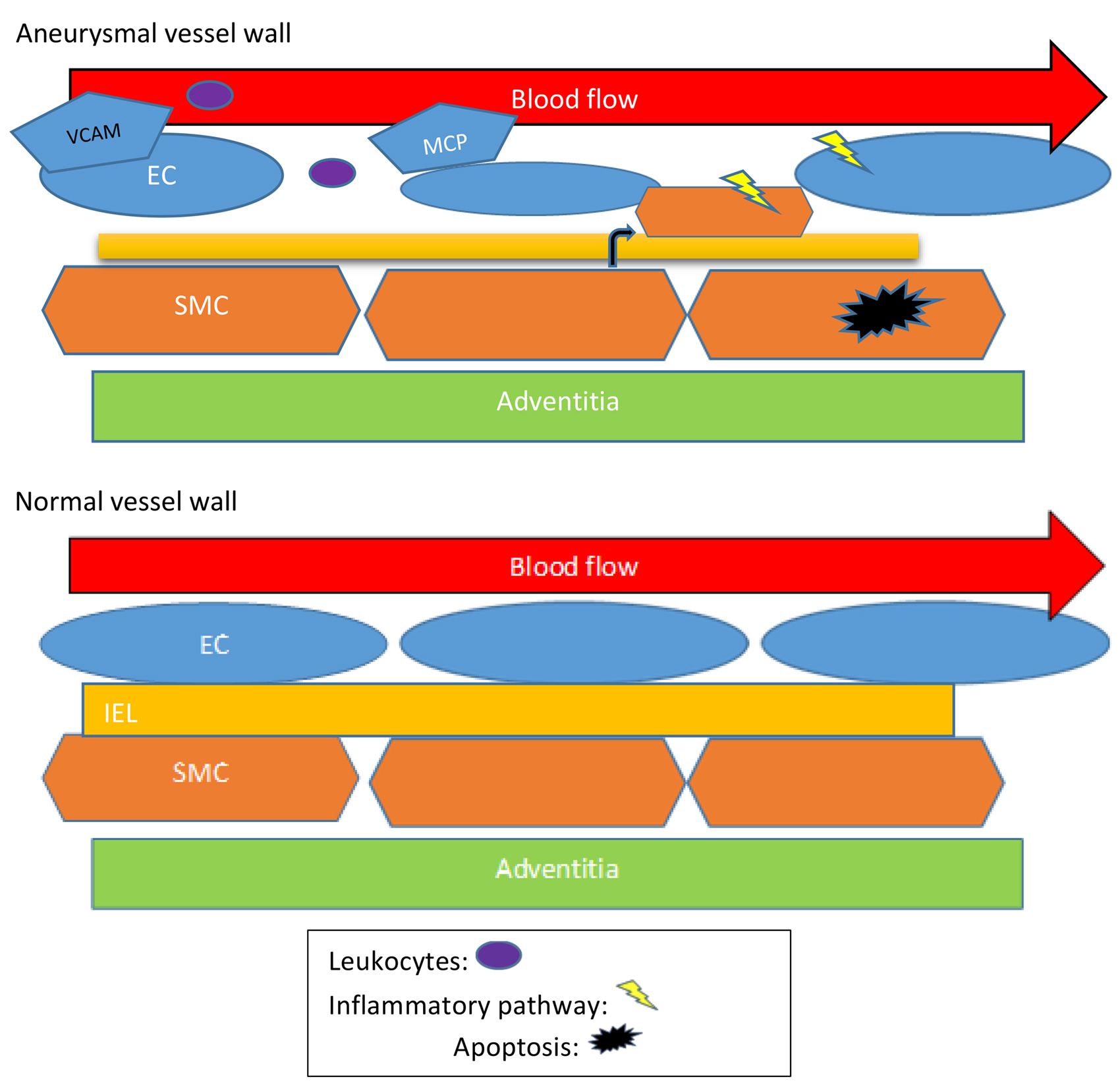
壁面剪切应力(WSS),是单位面积上由血管表面流动的液体产生的接 ...
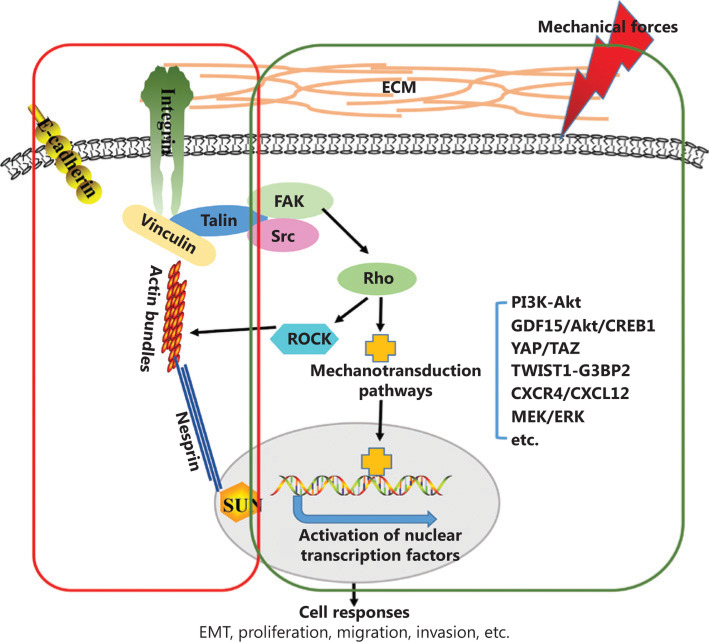
癌症在促进肿瘤表型表观遗传重编程和修饰的复杂组织微环境中发展。此 ...