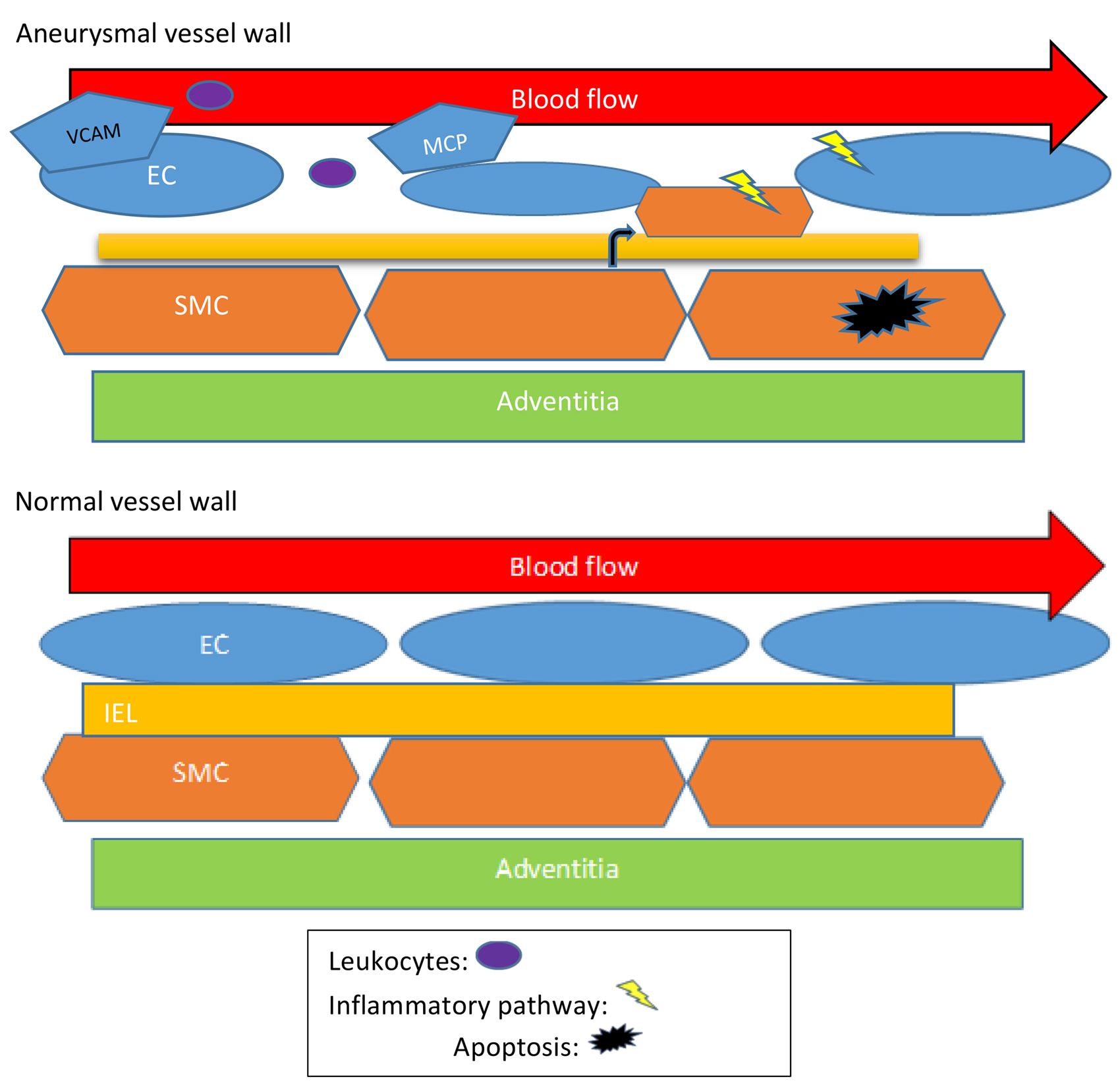
在正畸治疗期间,对牙齿施加机械力,导致牙槽骨的持续重塑。众所周知,破骨细胞在压力侧移除旧骨,而成骨细胞在张力侧形成新骨。在机械力诱导的骨重塑过程中,细胞骨架发挥着重要作用,将机械信号转化为化学信号,然后化学信号再转导到细胞中,调节分化、增殖、迁移和其他细胞过程。
据报道,多种信号通路参与成骨细胞的机械信号转导网络,如磷脂酰肌醇3-激酶(PI3K)、Jun 氨基末端激酶、粘着斑激酶和 STAT3/Girdin/Akt 通路。相比之下,破骨细胞中的机械信号转导机制在很大程度上尚未探索,因为破骨细胞是分化细胞,寿命短,仍然没有稳定的破骨细胞系。NF-κB 受体激活剂配体(RANKL)对于破骨细胞前体细胞激活和分化为破骨细胞至关重要。然而,尚不清楚机械力如何调节信号通路以促进破骨细胞前体细胞分化和融合成破骨细胞。
侵袭性伪足是一种富含肌动蛋白的膜突出物,能够介导细胞外基质的局灶降解,在肿瘤细胞侵袭迁移过程中发挥重要作用。在破骨细胞生成过程中,侵袭性伪足在破骨细胞融合中起关键作用,环状侵袭伪足的形成和破骨细胞融合都依赖于 Tks5,这是一种具有 N 端 phox 同源结构域(PX)的衔接蛋白,最初被确定为 Src 底物。基于先前的研究,山东省口腔组织再生重点实验室、山东大学口腔学院口腔正畸科、昆明医科大学附属口腔医院口腔正畸科的联合课题组曾假设正畸压缩力可能促进环状侵袭性伪足的形成以及破骨细胞前体与成熟破骨细胞的细胞间融合。这项研究旨在检验假设并探索正畸压缩力促进破骨细胞成熟的潜在信号机制。实验使用源自 Balb/c 小鼠的 RAW264.7 巨噬细胞样细胞系作为实验模型,研究正畸压缩力对这些细胞中侵袭性伪足形成和细胞-细胞融合的影响。

压力促进破骨细胞成熟和侵袭伪足的形成
抗酒石酸酸性磷酸酶(TRAP)染色一直是鉴定破骨细胞的可靠方法,实验对受到压应力的 RAW264.7 细胞进行了 TRAP 染色。与未暴露于压应力的 RAW264.7 细胞相比,结果发现,暴露于压应力的细胞中 TRAP 阳性细胞的百分比显著更高。这表明,压应力促进破骨细胞的成熟。
此外检测到,在受到压应力的 RAW264.7 细胞中形成了侵袭性伪足。用 Tks5 和 F-肌动蛋白抗体进行免疫染色显示,在暴露于压应力下,Tks5 和 F-肌动蛋白在 RAW264.7 细胞延伸的侵袭性伪足中积累,并融合了多个细胞。定量分析表明,暴露于压应力的 RAW264.7 细胞中具有环状侵袭性伪足的细胞百分比显著高于未施压的细胞。这表明,压应力促进了环状侵袭性伪足的形成和细胞融合。
压应力上调 Ets-1 和 Tks5 的表达,促进 Ets-1 在 RAW264.7 细胞中的激活
接下来研究了压缩应力促进环状侵袭性伪足形成和细胞融合的分子信号机制。因为 Tks5 是侵袭性伪足形成的主要调节因子,实验检测了压力对 Tks5 表达的影响。蛋白质印迹分析显示,与未施压的细胞相比,在受到压力的 RAW264.7 细胞中,Tks5 表达在蛋白质水平上调。此外,RT-PCR 分析显示,与未施压的细胞相比,在受到压力的 RAW264.7 细胞中,Tks5 表达在 mRNA 水平上调。这表明,压力在转录水平上调了 Tks5 的表达。为了确定负责 Tks5 上调的潜在转录因子,随后进行了生物信息学分析,并预测 Ets-1 是驱动 Tks5 表达的候选转录因子。此外,先前的研究表明,压缩力或剪切应力诱导 Ets-1 的上调和激活以调节基因表达。因此,检查了压力对 Ets-1 的表达和激活(磷酸化)的影响。蛋白质印迹分析显示,与未施压的细胞相比,在受到压应力的 RAW264.7 细胞中,Ets-1 蛋白和在 Thr38 处磷酸化的 Ets-1 水平显著增加。此外,PCR分析显示,与未施压的细胞相比,在受到压应力的RAW264.7细胞中,Ets- 1表达在mRNA水平上调。这表明,压应力激活 Ets-1 上调 Tks5 表达。
Tks5 是 Ets-1 在 RAW264.7 细胞中的转录靶点
为了确认压应力激活 Ets-1 以上调 Tks5 表达,实验用 Ets-1 过表达载体或 Ets-1 siRNA 转染 RAW264.7 细胞,以在蛋白质和 mRNA 水平上过表达或敲低 Ets-1。实验制作了包含 Tks5 野生型启动子区域和突变启动子区域的报告构建体,其中预测的 Ets-1 结合位点被删除。荧光素酶测定显示 Ets-1 过表达导致 Tks5 启动子的转录活性显著增加,但这可以通过删除 RAW264.7 细胞中 Tks5 启动子中预测的 Ets-1 结合位点来消除。此外,暴露于压应力显著增加了 Tks5 野生型启动子区域的转录活性,但不增加突变启动子区域的转录活性。然而,由压应力刺激的 Tks5 野生型启动子区域增加的转录活性被 RAW264.7 细胞中 Ets-1 的敲低消除。总之,这表明 Tks5 在基本条件和压应力条件下都是 RAW264.7 细胞中 Ets-1 的转录靶点。
压应力诱导 Tks5 上调、侵袭性伪足形成和细胞融合依赖于 Ets-1
为了确认 Ets-1 对压力诱导的 Tks5 上调、侵袭伪足形成和细胞融合至关重要,实验使用 Ets-1 shRNA 敲低 RAW264.7 细胞中的 Ets-1。基于免疫染色,结果发现,压缩应力显著增加了具有环状侵袭伪足的 RAW264.7 细胞的百分比,敲低 Ets-1 显著抑制了 RAW264.7 细胞在基本条件下和在压缩应力条件下环状侵袭伪足的形成。此外,Ets-1 的敲低显著抑制了 TRAP + 破骨细胞样 RAW264.7 细胞在基本条件和压缩应力条件下的融合。这些结果表明 Ets-1 介导了压应力对 Tks5 上调、侵袭性伪足形成和破骨细胞融合的影响。
总之,该研究证明了 Ets-1 被压缩应力上调,并且在压缩应力介导 Tks5 上调、侵袭性伪足形成和破骨细胞融合的作用中至关重要。研究结果为正畸治疗期间破骨细胞成熟和融合的机制提供了新的见解。
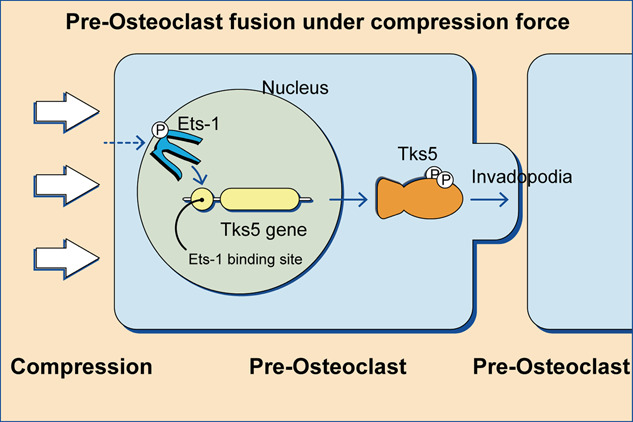
![]()
图1 压缩应力诱导破骨细胞侵袭伪足形成和细胞融合机制的示意图。
这项研究发现,压缩力诱导了 Tks5 的上调,这可以解释压缩力如何促进侵袭伪足的形成。基于这些发现提出了一个模型来解释压缩力如何促进破骨细胞成熟和融合。压缩力诱导 Ets-1 上调并导致 Ets-1 在 Thr38 位点磷酸化,接下来激活的 Ets-1 进入细胞核识别 Tks5 基因启动子区域中的 Ets-1 结合位点并驱动 Tks5 的转录,然后 Tks5 促进侵袭性伪足的形成和破骨细胞前体的融合。
参考文献:Wang Y, Zeng Z, Cheng Y, Zhao L, Yan Q, Qiu Y, Hu J, Guo J. Orthodontic compressive force modulates Ets-1/Tks5 pathway to promote the formation of circumferential invadopodia and the fusion of osteoclast precursors. J Cell Physiol. 2019 Aug;234(8):12685-12691. doi: 10.1002/jcp.27879. Epub 2018 Dec 6. PMID: 30523634.原文链接:https://pubmed-ncbi-nlm-nih-gov.proxy.library.carleton.ca/30523634/
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。如有任何的想法以及建议,关注公众号“Natrethink"了解更多体外仿生培养知识!
标签: